Trong các quy trình điều trị IVF/ICSI, bước đầu tiên và quan trọng nhất là thực hiện phác đồ kích thích buồng trứng có kiểm soát (COS). Thông thường, vào mỗi chu kỳ kinh nguyệt sẽ chỉ có một nang noãn trong buồng trứng phát triển và rụng xuống, nếu gặp được tinh trùng sẽ kết hợp và hình thành một phôi thai. Khả năng một phôi thai có thể làm tổ và tiếp tục phát triển vào khoảng 5 – 20%, tùy thuộc độ tuổi của phụ nữ. Các nang còn lại sẽ bị thoái hóa, còn noãn trưởng thành sẽ được phóng thích vào vòi trứng. Do đó, để có thể tăng tỷ lệ thành công trong điều trị vô sinh hiếm muộn, chúng ta cần phải thu hoạch được nhiều nang noãn hơn. Một chu kỳ IVF/ICSI sẽ cần từ 10-15 trứng trưởng thành để tiến hành thụ tinh. [1]
Vậy kích thích buồng trứng có kiểm soát (COS) là gì?
Kích thích buồng trứng có kiểm soát (Controlled Ovarian Stimulation - COS) là một phương pháp trong kỹ thuật thụ tinh trong ống nghiệm (IVF) để tăng số lượng trứng được sản xuất trong một chu kỳ sinh sản. Quá trình này bao gồm sử dụng hormone sinh dục để kích thích sự phát triển của các nang trứng trong buồng trứng, để đạt được số lượng trứng tối ưu nhằm mục đích thực hiện điều trị IVF/ICSI. Quy trình này được theo dõi chặt chẽ bằng siêu âm và xét nghiệm hormon để đảm bảo an toàn và hiệu quả. COS là một bước quan trọng trong quá trình IVF, cho phép những người vô sinh có cơ hội mang thai cao hơn. Kích thích buồng trứng sử dụng các hormone tác động lên trục nội tiết sinh sản nhằm thúc đẩy sự phát triển nang noãn buồng trứng và tăng số lượng nang noãn thu được, từ đó tăng cơ hội thụ tinh và thụ thai ở người phụ nữ.
Mục tiêu thực hiện phác đồ kích thích buồng trứng là để:
- Đảm bảo hiệu quả cao;
- Thu được số noãn tối ưu (10-15 noãn) giúp tăng tỷ lệ có thai;
- Đảm bảo an toàn, giảm thiểu nguy cơ và rủi ro;
- Giảm tỷ lệ mắc OHSS, giảm tỷ lệ hủy chu kỳ, giảm tỷ lệ đa thai. [2]
Sự phát triển nang noãn:
- Các nang noãn phát triển trong hai giai đoạn: giai đoạn không phụ thuộc hormon kéo dài khoảng 3 tháng trước chu kỳ kinh và giai đoạn phát triển phụ thuộc hormon FSH bắt đầu vào đầu chu kỳ kinh. [3]
- Nang sơ cấp (pre-antral follicle)
Lúc đầu chu kỳ kinh, nồng độ FSH tăng dần khiến một nhóm nang noãn phát triển vào giai đoạn nang sơ cấp với kích thước khoảng 200mm và nhiều tế bào hạt xung quanh. Số lượng receptor trên bề mặt các tế bào hạt tăng lên khoảng 1500 receptor/tế bào. Tại thời điểm này, tế bào hạt bắt đầu sản xuất 17 b-estradiol bằng cách thơm hoá (aromatization) androgen do tế bào vỏ sản xuất ra dưới tác dụng của LH (giả thuyết hai hormon hướng sinh dục, hai tế bào). Estradiol và FSH thúc đẩy phát triển tế bào hạt và tăng số lượng receptor trên màng tế bào hạt. Dịch nang bắt đầu hình thành và tích tụ trong nang.
- Nang thứ cấp (antral follicle)
Nang thứ cấp có kích thước khoảng 500mm. Vào ngày 5-7 của chu kỳ, chỉ có các nang trội mới có thể tiếp tục phát triển do có thể chuyển hoá androgen thành estrogen, trong khi các nang còn lại sẽ bị thoái hóa. Nang trội tiếp tục phát triển, bài tiết estradiol và inhibin B, làm giảm tiết FSH từ tuyến yên. FSH kích thích sự xuất hiện của receptor LH trên bề mặt tế bào hạt. Khi nồng độ estradiol tăng dần sẽ kích thích sự giải phóng của đỉnh LH từ tuyến yên, xảy ra khi nồng độ E2 đạt đỉnh vào 12-14 giờ. Ít nhất 33 chất điều hoà sự phát triển và thoái triển của nang đã được xác định, bao gồm các peptid của buồng trứng, trong đó Insulin-Like Growth factor I (IGF-I) đóng vai trò quan trọng trong khuyến khích quá trình thơm hoá, kích thích sự phân bào của tế bào hạt và tăng số lượng receptor LH. Inhibin ức chế sản xuất FSH, Activin.
- Nang noãn trước phóng noãn (preovulate follicle)
Nang noãn trước phóng noãn căng tròn và chứa dịch nang. Chúng được gắn vào thành nang bởi cuống và có các tế bào gò noãn (oophoros cumulus). Siêu âm đầu dò tần số cao có thể thấy gò noãn trước phóng noãn khoảng 36 giờ. Sự tăng nồng độ estrogen làm tăng bài tiết LH. Đỉnh LH làm cho nang noãn hoàng thể hóa và kích thích tế bào hạt sản xuất progesterone. LH kích thích sản xuất cytokin trong đó chất được biết đến nhiều nhất là Interlekin-1 (IL-1) có tác dụng khởi phát prostaglandin và proteolytic làm cho nang noãn vỡ ra. Phóng noãn xảy ra khoảng 34-36 giờ sau đỉnh LH, khi nang noãn đạt kích thước trung bình 20 mm, noãn trong nang noãn giải phóng ra, di chuyển theo vòi tử cung về buồng tử cung. Sau khi phóng noãn, các tế bào nang còn lại trở thành hoàng thể và tiếp tục sản xuất estradiol, progesterone và inhibin, các chất này ức chế sự phát triển của các nang khác. Cuối giai đoạn hoàng thể, nếu không có hCG, hoàng thể sẽ bị teo đi làm cho nồng độ các hormone buồng trứng tụt xuống làm bong niêm mạc tử cung, và tạo điều kiện cho hormone FSH tăng dần bắt đầu một chu kỳ buồng trứng mới.
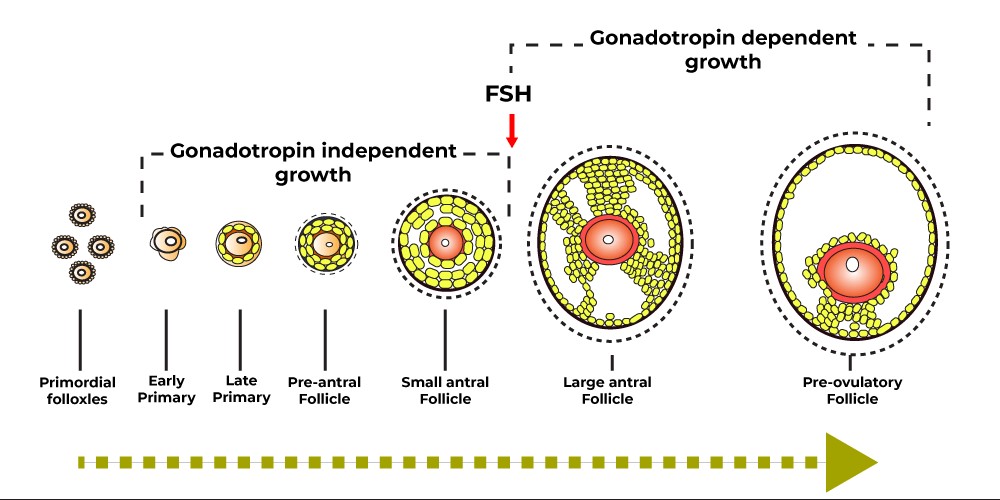
Hình 1: Sự phát triển của nang noãn
Đối với chu kỳ thực hiện IVF/ICSI, kích thích nang noãn thường được thực hiện với FSH tái tổ hợp và GnRH analogue nhằm ức chế sự xuất hiện đỉnh LH sớm. Vào cuối chu kỳ, hCG hoặc GnRH agonist được sử dụng để “mô phỏng” sự gia tăng LH nội sinh tự nhiên để kích hoạt sự trưởng thành của tế bào trứng và bắt đầu quá trình rụng trứng. Khi thực hiện kích thích buồng trứng, phụ thuộc vào từng yếu tố bệnh nhân (cá nhân hóa) mà kết quả có thể được phân loại thành 4 nhóm chính [4]:
- Đáp ứng kém (poor responders) theo tiêu chí Bologna: ≤ 3 tế bào trứng thu được
- Đáp ứng cận tối ưu (sub-optimal responder): 4 đến 9 tế bào trứng thu được
- Đáp ứng bình thường (normal responder): 10 đến 15 tế bào trứng thu được
- Đáp ứng quá kích (hyper-responder): ≥ 15 tế bào trứng thu được
Do vậy, việc xác định, phân loại người bệnh là mấu chốt để lựa chọn chiến lược điều trị chính xác.
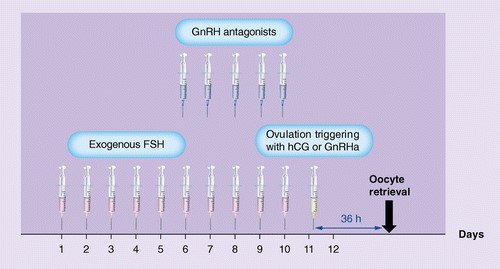
Nhiều yếu tố ảnh hưởng đến lựa chọn phác đồ và đáp ứng trong kích thích buồng trứng đã được chứng minh như [5]:
- Tần số và khoảng rộng của xung GnRH
- Các đồng thể khác nhau của FSH và LH
- Đa hình gen thụ thể FSH
- Tín hiệu nội bào
- Sự khác biệt giữa các cá thể (độ tuổi, chỉ số BMI, AMH, AFC và tình trạng nội tiết, cơ sở hormone kích thích nang huyết thanh-FSH)
Trong HTSS, sự kết hợp của nhiều yếu tố có thể làm trầm trọng thêm sự giảm nồng độ và hoạt tính sinh học của FSH, LH dẫn đến đáp ứng kém hoặc cận tối ưu đối với kích thích buồng trứng [5].
Các biến đổi di truyền được cho là sự nhạy cảm với kích thích buồng trứng và đáp ứng kém hoặc cận tối ưu ở một số người bệnh. Các nghiên cứu đã chứng minh rằng một số vị trí đa hình đơn nucleotide (SNPs) trên gen mã hóa thụ thể hormone kích thích nang noãn (FSHR) hoặc gen mã hóa tiểu đơn vị β của hormone LH có liên quan đến sự thay đổi của việc đáp ứng kích thích buồng trứng. Vì vậy, một số phụ nữ thuộc nhóm đáp ứng kém hoặc cận tối ưu có thể mang một trong những SNPs này và cần liều gonadotropin cao hơn hoặc kích thích kéo dài, khác với dự đoán đáp ứng kích thích dựa trên dấu hiệu dự trữ buồng trứng [6].
Có hàng trăm biến thể (variants) hoặc vị trí đa hình đơn nucleotide (SNPs) phổ biến trên gen mã hóa FSHR đã được xác định. Trong đó, 4 biến thể gen (rs6165, rs6166, rs1394205, rs10835638) cho thấy có thể có liên quan đến sự suy giảm chức năng buồng trứng và ảnh hưởng đến hiệu quả của việc kích thích buồng trứng có kiểm soát đối với người nữ có chức năng buồng trứng bình thường [7].
- Đa hình rs6165: Allele G tại vị trí 919 (c.919G>A). p.Ala307Thr. Thay thế axit amin dẫn đến sự thay đổi từ một axit amin có tính phân cực thành một axit amin không phân cực, hydrophobic amino acid và loại bỏ một vị trí glycosyl hóa liên kết O tiềm năng (potential O-linked glycosylation site). Biến thể 307Ala/Ala (G/G) liên quan đến đáp ứng buồng trứng kém. [8, 9]
- Đa hình rs6166: Allele G tại vị trí 2039 (c.2039G>A). p.Ser680Asn. Thay thế axit amin dẫn đến một vị trí phosphoryl hóa tiềm năng trong miền nội bào của thụ thể. Biến thể 680Ser/Ser (G/G) liên quan đến đáp ứng buồng trứng kém [10, 11].
- Đa hình rs1394205: SNP nằm ở vùng promoter của gen FSHR, trình tự ngược dòng (upstream) của codon khởi đầu dịch mã (c.-29G>A). Biến thể A/A liên quan đến đáp ứng buồng trứng kém [12, 13].
- Đa hình rs10835638: SNP nằm ở vùng promoter của gen FSHB ảnh hưởng đến quá trình phiên mã của gen (c.-211G>T). Biến thể T/T và G/T liên quan đến đáp ứng buồng trứng kém [14].
Hiện tại, GENTIS đang thực hiện xét nghiệm đa hình gen thụ thể FSH cho phép xác định các biến thể di truyền liên quan đến đáp ứng với kích thích buồng trứng. Cụ thể là:
FSHR: rs6165, rs6166, rs1394205
FSHB: rs10835638
Kích thích buồng trứng (KTBT) có vai trò quan trọng trong các kỹ thuật HTSS. Phác đồ KTBT có thể sử dụng FSH đơn thuần hoặc phối hợp cho tỉ lệ thai lâm sàng cao. Không có một phác đồ KTBT lý tưởng cho tất cả các bệnh nhân, do đó cần chọn lựa một phác đồ KTBT phù hợp dựa trên nhiều yếu tố như tuổi vợ, dự trữ buồng trứng, tiền sử các lần KTBT trước đó và đa hình gen thụ thể FSH. Sử dụng phù hợp, đúng cách, theo dõi cẩn thận phác đồ KTBT sử dụng FSH sẽ hạn chế được các biến chứng mà tỉ lệ thai lâm sàng cao.
Tài liệu tham khảo:
[1] Gallos, Ioannis D et al. “Controlled ovarian stimulation protocols for assisted reproduction: a network meta‐analysis.” The Cochrane Database of Systematic Reviews vol. 2017,3 CD012586. 9 Mar. 2017, doi:10.1002/14651858.CD012586
[2] Quaas, Alexander M, and Richard S Legro. “Pharmacology of medications used for ovarian stimulation.” _Best practice & research. Clinical endocrinology & metabolism_ vol. 33,1 (2019): 21-33. doi:10.1016/j.beem.2018.10.002
[3] Araújo, Valdevane R et al. “In vitro culture of bovine preantral follicles: a review.” Reproductive biology and endocrinology : RB&E vol. 12 78. 13 Aug. 2014, doi:10.1186/1477-7827-12-78
[4] Vaiarelli, A., Cimadomo, D., Ubaldi, N., Rienzi, L., & Ubaldi, F. M. (2018). What is new in the management of poor ovarian response in IVF?. Current opinion in obstetrics & gynecology, 30(3), 155–162. https://doi.org/10.1097/GCO.0000000000000452
[5] Bosch, E, et al. “Reduced FSH and LH Action: Implications for Medically Assisted Reproduction.” Human Reproduction, vol. 36, no. 6, 2021, pp. 1469–1480., https://doi.org/10.1093/humrep/deab065.
[6] Simoni, M et al. “Functional genetic polymorphisms and female reproductive disorders: Part I: Polycystic ovary syndrome and ovarian response.” Human reproduction update vol. 14,5 (2008): 459-84. doi:10.1093/humupd/dmn024
[7] Conforti, Alessandro et al. “Effect of Genetic Variants of Gonadotropins and Their Receptors on Ovarian Stimulation Outcomes: A Delphi Consensus.” Frontiers in endocrinology vol. 12 797365. 1 Feb. 2022, doi:10.3389/fendo.2021.797365
[8] Simoni, Manuela, and Livio Casarini. “Mechanisms in endocrinology: Genetics of FSH action: a 2014-and-beyond view.” European journal of endocrinology vol. 170,3 R91-107. 4 Feb. 2014, doi:10.1530/EJE-13-0624
[9] Alviggi, Carlo et al. “Clinical relevance of genetic variants of gonadotrophins and their receptors in controlled ovarian stimulation: a systematic review and meta-analysis.” Human reproduction update vol. 24,5 (2018): 599-614. doi:10.1093/humupd/dmy019
[10] Aittomäki, K et al. “Mutation in the follicle-stimulating hormone receptor gene causes hereditary hypergonadotropic ovarian failure.” Cell vol. 82,6 (1995): 959-68. doi:10.1016/0092-8674(95)90275-9
[11] Alviggi, Carlo et al. “In Estimated Good Prognosis Patients Could Unexpected "Hyporesponse" to Controlled Ovarian Stimulation be Related to Genetic Polymorphisms of FSH Receptor?.” Reproductive sciences (Thousand Oaks, Calif.) vol. 23,8 (2016): 1103-8. doi:10.1177/1933719116630419
[12] Wunsch, Alain et al. “Single-nucleotide polymorphisms in the promoter region influence the expression of the human follicle-stimulating hormone receptor.” Fertility and sterility vol. 84,2 (2005): 446-53. doi:10.1016/j.fertnstert.2005.02.031
[13] Lindgren, I et al. “Gonadotropin receptor variants are linked to cumulative live birth rate after in vitro fertilization.” Journal of assisted reproduction and genetics vol. 36,1 (2019): 29-38. doi:10.1007/s10815-018-1318-y
[14] Schüring, Andreas N et al. “Effects of the FSH-β-subunit promoter polymorphism -211G->T on the hypothalamic-pituitary-ovarian axis in normally cycling women indicate a gender-specific regulation of gonadotropin secretion.” The Journal of clinical endocrinology and metabolism vol. 98,1 (2013): E82-6. doi:10.1210/jc.2012-2780











