| Đào Mai Anh1, Gary L Harton2, Nguyễn Quang Vinh1, Nguyễn Văn Huynh1, Hoàng Thị Nhung1, Phạm Thúy Nga3, Lê Thị Thu Hiền4, Nguyễn Minh Đức4, Trần Quốc Quân1 1 Công ty Cổ phần Dịch vụ Phân tích Di truyền GENTIS 2 PerkinElmer Health Sciences Australia 3 Bệnh viện Phụ Sản Hà Nội 4 Bệnh viện Nam học & Hiếm muộn Hà Nội |
Tóm tắt
Mục tiêu: Thiết kế, tối ưu và xây dựng quy trình cho thực hiện đồng thời xét nghiệm PGT-A và PGT-M cho bệnh thalassemia, sử dụng hệ thống giải trình tự thế hệ mới cho phép kiểm tra đồng thời các đột biến trong gen HBB và các dấu chuẩn đa hình đơn nucleotide (SNP).
Phương pháp: Thiết kế và tối ưu quy xét nghiệm kết hợp PGT-A và PGT-M cho bệnh nhân IVF tại Việt Nam, trong đó xét nghiệm thực hiện sử dụng hệ thống giải trình tự thế hệ mới cho phép kiểm tra các đột biến gây bệnh beta-thalassemia đồng thời cùng lượng lớn các đa đình SNP sử dụng cho phân tích di truyền liên kết và kiểm soát nhiễm chéo.
Kết quả: Đến nay, 2 trường hợp đã hoàn thành toàn bộ quy trình bao gồm cả chuyển phôi trong khi 9 trường hợp khác đã hoàn thành phân tích IVF và PGT-M/A nhưng vẫn chưa hoàn thành chuyển phôi. Trong 2 trường hợp được chuyển phôi, cả 2 bệnh nhân đều có thai với phôi thai không mang bất thường dị bội và không mắc bệnh beta-thalassemia, đã được xác nhận bằng xét nghiệm chọc ối. Trong 9 trường hợp tiếp theo, 39 phôi được sinh thiết và khuếch đại toàn hệ gen, đạt tiêu chuẩn cho thực hiện xét nghiệm. Có 8 phôi không mang gen bệnh, 31 phôi mang đột biến dạng dị hợp tử và 11 phôi mang đột biến dạng đồng hợp tử/dị hợp tử kép. Trong đó, kết quả xét nghiệm PGT-A cũng chỉ ra 22 phôi lưỡng bội và 2 phôi mang bất thường lệch bội.
Thảo luận: Ở đây chúng tôi báo cáo ứng dụng của quy trình xét nghiệm cho 11 cặp bệnh nhân, trong đó đưa ra các kết quả chi tiết đối với 2 trường hợp đã thực hiện chuyển phôi và thực hiện các xét nghiệm chẩn đoán trước sinh.
Từ khóa:
Xét nghiệm di truyền trước chuyển phôi cho các bệnh đơn gen (PGT-M)
Xét nghiệm di truyền trước chuyển phôi (PGT-A)
Sinh thiết phôi
Thể dị bội
Beta thalassemia
Giới thiệu:
Xét nghiệm di truyền trước chuyển phôi cho các bệnh di truyền đơn gen (PGT-M) được thực hiện lần đầu tiên vào năm 1990 (Handyside AH, 1990). Xét nghiệm áp dụng cho bệnh nhân (IVF), phôi được sinh thiết lấy ra một hoặc một vài tế bào để thực hiện xét nghiệm (Handyside 1990).
Đối với xét nghiệm sinh học phân tử, việc sử dụng mẫu sinh thiết gồm một số tế bào có lợi thế hơn sử dụng sinh thiết một tế bào, bao gồm giảm tỷ lệ allele drop-out (ADO) và khuếch đại ưu tiên (preferential amplification-PA). ADO phát sinh trong giai đoạn đầu của quá trình khuếch đại của phản ứng PCR, trong đó một allele không được gắn mồi và các sản phẩm khuếch đại cho allele này không được tạo ra. Trong trường hợp kiểu gen dị hợp tử, điều này có nghĩa là sẽ bỏ sót một allele và có thể dẫn đến chẩn đoán nhầm là phôi mang kiểu gen đồng hợp tử (Findlay I, 1995). Hiện tượng khuếch đại ưu tiên tương tự như ADO, khác biệt ở việc sản phẩm PCR của 1 allele được tạo ra nhiều hơn một cách ưu thế so với allele còn lại. Như vậy, điều này có thể dẫn đến sai lầm trong đưa ra kết luận. Dreesen’s và các đồng nghiệp đã công bố một một tổng quan chi tiết về các khả năng đưa ra kết luận sai lầm trong xét nghiệm PGT-M (PGD) (Dreesen J, 2014).
Các phương pháp mới đã được phát triển để loại bỏ hoặc ít nhất là giảm thiểu một số vấn đề trên. Nhiều nhóm nghiên cứu bắt đầu thêm các marker sử dụng cho phân tích di truyền liên kết, điển hình là các STR (short tandem repeat) được tìm thấy bên trong gen hoặc liên kết chặt chẽ với gen quan tâm (Rechitsky S. 1998). Việc sử dụng các marker này cho phép phân tích thứ cấp về di truyền liên kết của gen và cũng cho phép phòng thí nghiệm theo dõi sự nhiễm DNA từ các nguồn ngoại sinh bao gồm mẹ, cha, nhân viên phòng thí nghiệm IVF và nhân viên phòng thí nghiệm phân tử. Kỹ thuật này tiếp tục là công cụ chính cho PGT-M ngày nay.
Năm 2010, Handyside và các đồng nghiệp đã công bố một phương pháp mới để chẩn đoán di truyền trước chuyển phôi cho hầu hết các bệnh (trong trường hợp đã xác định được gen mang đột biến gây bệnh). Công nghệ này, được gọi là Karyomapping, sử dụng một panel khoảng 300000 SNP đặc hiệu trên toàn bộ hệ gen (Handyside AH, 2010). Bằng cách xác định NST mà phôi được thừa hưởng từ cha mẹ, Karyomapping có thể xác định được kiểu gen của vùng gen quan tâm. Karyomapping cũng cho phép phát hiện một số bất thường lệch bội trên phôi, tuy nhiên không phải tất cả các bất thường lệch bội đều có thể phát hiện chính xác. Ngoài ra, chi phí cho kĩ thuật Karyomapping được đánh giá là cao hơn phương pháp sử dụng phản ứng PCR truyền thống, bên cạnh đó yêu cầu nhiều mẫu tham chiếu từ các thành viên trong gia đình không phải lúc nào cũng khả thi.
Một hệ thống thương mại khác được phát triển bởi Agilent cho phép phân tích đồng thời cả các bệnh di truyền đơn gen và các bất thường lệch bội phổ biến. Công nghệ này được gọi là OnePGT, sử dụng kỹ thuật MDA (multiple displacement amplification) cho quá trình khuếch đại toàn hệ gen (WGA). Công nghệ này sử dụng công nghệ giải trình tự thế hệ mới với yêu cầu 16.106 reads/mẫu để đảm bảo độ chính xác cho phân tích PGT-M. Trong công bố về phương pháp này, kết quả giữa các xét nghiệm lặp lại (trên cùng 1 sản phẩm WGA hoặc giữa 2 mẫu sinh thiết từ cùng một phôi) có độ lặp lại cao, trong đó 15% mẫu không thể phân tích do hiện tượng trao đổi chéo.
Hàng ngàn chu kỳ IVF thực hiện xét nghiệm PGT-M đã được thực hiện trên toàn thế giới kể từ khi xét nghiệm đầu tiên được thực hiện năm 1992. Hàng ngàn đột biến gen đơn lẻ khác nhau có thể được sàng lọc ở phôi trước khi chuyển phôi (De Rycke M, 2017). Trong 10 năm qua, phần lớn các trường hợp đã chuyển từ sinh thiết phôi nang đơn tế bào ngày 3 sang sinh thiết phôi ở giai đoạn phát triển muộn hơn, xảy ra từ ngày thứ 5 đến ngày thứ 7 của quá trình phát triển phôi, tuy nhiên thể dị bội trong các chu kỳ PGT-M vẫn là một vấn đề. Mặc dù kết quả PGT-M có thể chỉ ra rằng phôi không bị ảnh hưởng bởi bệnh đơn gen, thì xét nghiệm PGT-M tiêu chuẩn không thể phát hiện trong trường hợp phôi mang bất thường lệch bội. Tùy thuộc vào tuổi của bệnh nhân nữ, khoảng từ 44% đến 75% số phôi được chuyển này có thể mang bất thường lệch bội.
Thalassemia ảnh hưởng đến khoảng 1,5% dân số toàn cầu và 1,5% dân số Việt Nam là người mang bệnh beta-thalassemia (Galanello R. 2010, Nguyễn HN. 2015). Các cặp vợ chồng mang gen beta-thalassemia thường thực hiện IVF và PGT-M để đám bảo người con sinh ra không mắc bệnh.
Ở đây chúng tôi mô tả một phương pháp cho phép phân tích đột biến beta-thalassemia và phân tích di truyền liên kết (sử dụng SNP) đồng thời phân tích bất thường số lượng ở 24 nhiễm sắc thể. Phương pháp này sử dụng sản phẩm WGA cho phép phát hiện bất thường cấu trúc >10 MB cùng với việc làm giàu trình tự đích (TSE) để khuếch đại bộ SNP đặc hiệu cho liên kết với gen HBB. Phương pháp này cho phép giảm thiểu hiện tượng ADO và AP đối với bệnh beta-thalassemia, PGT-M và PGT-A được thực hiện đồng thời trong cùng một lần giải trình tự.
Vật liệu và phương pháp:
Sinh thiết phôi được rửa và chứa trong ống PCR 0,2 ml vô trùng và thực hiện phản ứng WGA bằng bộ kit DOPlify (PerkinElmer Inc. Waltham, MA), tuân theo quy trình TSE mà hãng khuyến cáo. Các SNP đặc hiệu sử dụng là các SNP nằm trong phạm vi 300kb nằm về 2 đầu của gen HBB và đáp ứng yêu cầu tần số dị hợp tử > 0,3.
Sau quá trình khuếch đại WGA ban đầu, phản ứng PCR làm giàu thứ cấp được thực hiện bằng cách sử dụng sản phẩm WGA làm DNA khuôn mẫu cùng với các mồi đặc hiệu khuếch đại vùng HBB và các SNP quan tâm. Sản phẩm PCR được bổ sung sản phẩm WGA trước khi chuẩn bị thư viện bằng bộ kit Nextera XT DNA (Illumina, Inc., San Diego, CA USA) (tỷ lệ sản phẩm WGA: sản phẩm PCR = 10: 1).
Giải trình tự được thực hiện trên hệ thống máy Miseq (Illumina)-1 chiều-76 chu kỳ và so sánh với hệ gen tham chiếu Hg19, sử dụng phần mềm Miseq Reporter. Dữ liệu giải trình tự được phân tích bằng phần mềm Nexus Copy Number (BioDiscovery, Los Angeles, CA USA) hoặc PG-Find cho phát hiện bất thường số lượng và bất thường cấu trúc NST và Miseq Reporter cho phân tích đột biến và phân tích di truyền liên kết sử dụng SNP.
Kết quả
Hai trường hợp đã sử dụng quy trình được thiết kế để sàng lọc trước chuyển phôi. 7 phôi được sinh thiết và thực hiện xét nghiệm đối với cặp vợ chồng thứ nhất và 5 phôi được thực hiện đối với cặp vợ chồng thứ 2. Sau quá trình WGA, 1/12 mẫu có sản phẩm WGA không đạt tiêu chuẩn và không được tiếp tục thực hiện xét nghiệm (hiệu suất khuếch đại 91,7%).
Trong mỗi trường hợp, phôi chuyển được lựa chọn dựa trên kết quả sàng lọc PGT-A kết hợp với PGT-M. Thêm vào đó, 9 cặp vợ chồng khác cũng đã thực hiện IVF và sàng lọc phôi theo quy trình nêu trên. Tại thời điểm thực hiện bài viết này, chúng tôi đang chờ thông tin về phôi đã được chuyển cũng như kết quả lâm sàng của quá trình chuyển phôi từ các trung tâm IVF đối tác của chúng tôi.
Trong trường hợp thứ nhất, 7 phôi được sinh thiết ở giai đoạn phôi nang, cả 7 phôi đều được WGA thành công và được phân tích các đột biến trên gen HBB. Đối với trường hợp này, người bố mang đột biến CD17 dị hợp tử và người mẹ mang đột biến -28M dị hợp tử trên gen HBB. Trong tất cả các trường hợp, 12 SNP khác trong và xung quanh gen HBB cũng được sử dụng để phân tích di truyền liên kết và kiểm soát nhiễm chéo từ các nguồn DNA ngoại sinh. Kết quả PGT-M cho thấy 2 phôi mang đột biến dị hợp tử kép (Phôi A và B), 2 phôi mang đột biến trên gen HBB của bố (C và E), 1 phôi mang đột biến của mẹ (F) và 2 phôi không mang đột biến. 7 phôi trên cũng được thực hiện sàng lọc PGT-A, kết quả cho thấy 4 phôi lưỡng bội (A, D, F và G) và 3 phôi lệch bội (B, C và E). Phôi F đã được chọn để chuyển và ghi nhận kết quả mang thai đơn. Kết quả chọc ối cho thấy thai phụ mang thai bé gái, có kiểu gen HBB phù hợp với kết quả PGT-M.
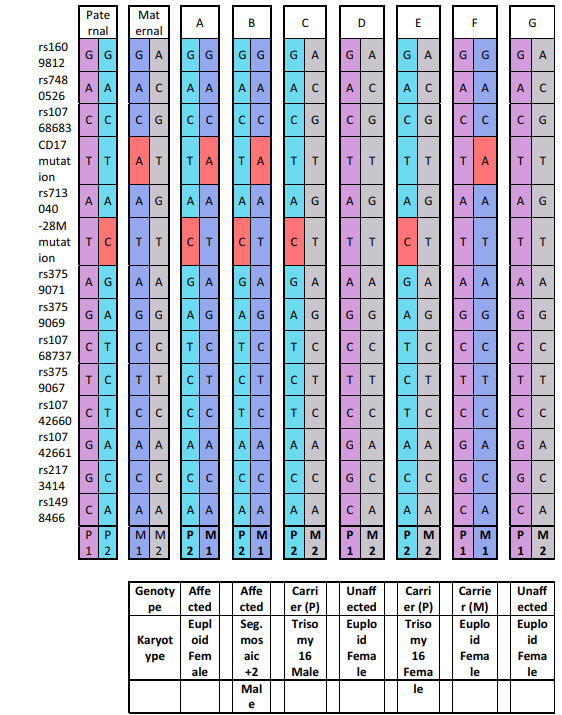
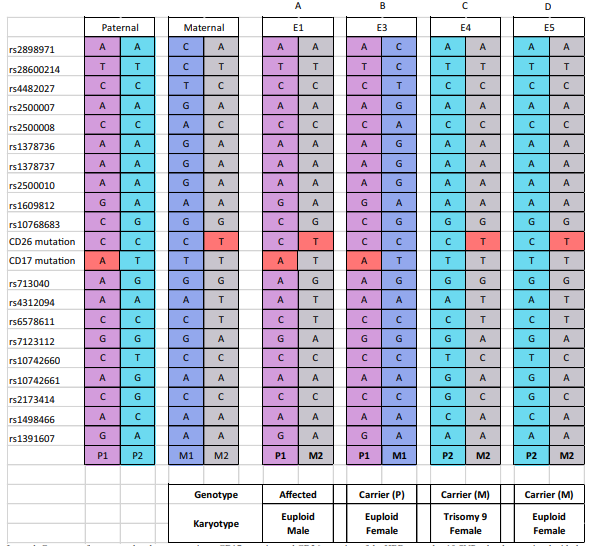
Trong trường hợp thứ hai, 5 phôi được thực hiện sinh thiết và 4 phôi có kết quả WGA đạt tiêu chuẩn để tiếp tục thực hiện xét nghiệm. Trong trường hợp này, người bố mang đột biến CD26 dị hợp tử, còn người mẹ mang đột biến CD17 dạng dị hợp tử. 19 SNP nằm về hai phía của gen HBB được sử dụng cho xác nhận kết quả bằng di truyền liên kết và kiếm soát nhiễm chéo. Kết quả xét nghiệm PGT-M chỉ ra 1 phôi mang đột biến dạng dị hợp tử kép (A), 2 phôi mang đột biến CD17 dạng dị hợp tử (C, D) và 1 phôi mang đột biến CD26 dạng dị hợp tử (B). Kết quả PGT-A cũng chỉ ra 3 phôi lưỡng bội (A, B, D) và 1 phôi mang bất thường lệch bội (trisomy 9). Phôi B được lựa chọn cho chuyển phôi, xét nghiệm chọc ối được thực hiện khi bệnh nhân mang thai đã xác nhận thai giới tính nữ lưỡng bội và mang đột biến dạng dị hợp tử trên gen HBB tương đồng với kết quả PGT-M.
Thảo luận
Trong nghiên cứu này, chúng tôi báo cáo quy trình kết hợp PGT-M cho bệnh beta thalassemia và PGT-A trong cùng một xét nghiệm. Hai bệnh nhân IVF đã thực hiện quy trình này và có kết quả 2 trẻ sinh sống có bộ NST lưỡng bội và không mắc bệnh beta thalassemia.
Trong báo cáo poster tại Hội nghị PGD-IS (Bangkok, Thailand), Warren và cộng sự đã so sánh hiệu quả của quy trình TSE so với quy trình PCR truyền thống kết hợp với bổ sung mồi vào phản ứng WGA. Khác với phương pháp PCR truyền thống, quy trình TSE kết hợp với phân tích các marker STR có thể sàng lọc đột biến trên gen BRCA mà không ghi nhận hiện tượng ADO và PA.
Tổng cộng, 11 phôi đã được thực hiện với quy trình xét nghiệm nêu trên. Trong đó 10/11 phôi (90.9%) đã được sàng lọc đồng thời đột biến gen gây bệnh beta thalassemia và bất thường số lượng 24 NST. Kết quả sàng lọc đột biến gen gây bệnh beta thalassemia cho thấy 3 phôi mang đột biến dị hợp tử kép, 5 phôi mang đột biến dị hợp tử và 2 phôi không mang đột biến. Trong khi đó, kết quả sàng lọc bất thường số lượng 24 NST báo cáo 7 phôi lưỡng bội và 4 phôi lệch bội, trong đó có 1 phôi thể khảm (+4p).
Beta-thalassemia ảnh hưởng đến một lượng lớn bệnh nhân ở Châu Á, vì vậy việc có một xét nghiệm đáng tin cậy, hiệu quả về chi phí và cho phép kết hợp PGT-M và PGT-A trong cùng một xét nghiệm là một bước tiến thực sự cho khu vực châu Á. Không phụ thuộc vào nguyên nhân làm IVF, luôn có một tỷ lệ nhất định phôi mang bất thường NST. Trong khi các bệnh nhân có nguy cơ mắc bệnh beta thalassemia thường có khả năng sinh sản bình thường, nhưng vẫn sẽ có một tỷ lệ nhất định phôi thất bại làm tổ do nguyên nhân lệch bội. Chính vì vậy, việc kết hợp hai xét nghiệm PGT-M và PGT-A trong cùng một quy trình giúp lựa chọn phôi lưỡng bội và không mang gen gây bệnh thalassemia, quy trình này cũng nên được áp dụng với các bệnh đơn gen khác.
References:
- Handyside AH, Kontogianni EH, Hardy K, Winston RM. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. 1990 Apr 19;344(6268):768-70.
- Chong SS, Kristjansson K, Cota J, Handyside AH, Hughes MR. Preimplantation prevention of X-linked disease: reliable and rapid sex determination of single human cells by restriction analysis of simultaneously amplified ZFX and ZFY sequences. Hum Mol Gen. 1993 2(8):1187-1191.
- De Rycke M, Goossens V, Kokkali G, Meijer-Hoogeveen M, Coonen E, Moutou C. EHSRE PGD Consortium data collection XIV-XV: cycles from January 2011 to December 2012 with pregnancy follow-up to October 2013. Hum Reprod. 2017 32(10):1974-1994.
- Kokkali G, Vrettou C, Traeger-Synodinos J, Jones GM, Cram DS, Stavrou D, Trounson AO, Kanavakis E, Pantos K. Birth of a healthy infant following trophectoderm biopsy from blastocysts for PGD of beta-thalassemia major. Hum Reprod. 2005 Jul:20(7):1855-9.
- Scott RT, Upham KM, Forman EJ, Zhao T, Treff NR. Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial. Fertil Steril. 2013 Sep;100(3):624-30.
- Findlay I, Ray P, Quirke P, Rutherford A, Lilford R. Allelic drop-out and preferential amplification in single cells and human blastomeres: implications for preimplantation diagnosis of sex and cystic fibrosis. Hum Reprod. 1995 Jun:10(6):1609-18.
- Dreesen J, Destouni A, Kourlaba G, Degn B, Mette WC, Carvalho F, Moutou C, Sengupta S, Shanjal S, Renwick P, Davies S, Kanavakis E, Harton G, Traeger-Synodinos J. Evaluation of PCR-based preimplantation genetic diagnosis applied to monogenic diseases: a collaborative ESHRE PGD consortium study. Eur J Hum Genet. 2014 Aug;22(8):1012-8.
- Rechitsky S, Strom C, Verlinsky O, Amet T, Ivakhenko V, Kukharenko V, Kuliev A, Verlinsky Y. Allele dropout in polar bodies and blastomeres. J Assit Reprod Genet. 1998 May;15(5):253-7.
- Handyside AH, Harton GL, Mariani B, Thornhill AR, Affara N, Shaw MA, Griffin DK. Karyomapping: a universal method for genome wide analysis of genetic disease based on mapping crossovers between parental haplotypes. J Med Genet. 2010 Oct;47(10):651-8.
- Franasiak JM, Forman EJ, Hong KH, Werner MD, Upham KM, Treff NR, Scott Jr. RT. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening. Fertil Steril. 2014 Mar;101(3):656-63.
- Hassold T, Chen N, Funkhouser J, Jooss T, Manuel B, Matsuura J, et al.. A cytogenetic study of 1000 spontaneous abortuses. Hum.Genet. 1980; 44:151-178.
- Munne ́ S, Alikani M, Tomkin G, Grifo J, Cohen J. Embryo morphology, developmental rates, and maternal age are correlated with chromosome abnormalities. Steril. 1995;64:382–391.
- Yang Z, et al. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Mol Cytogenet. 2012;5(1):24.
- Forman EJ et al. In vitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertil Steril. 2013;100(1):100-107.
- Tiegs et al. O-74. Fert and Stert. Vol. 122(35). Pe31. American Society for Reproductive Medicine Annual Meeting. Philadelphia, PA. 2019.
- Harton GL, et al. Diminished effect of maternal age on implantation after preimplantation genetic diagnosis with array comparative genetic hybridization. Fertil Steril. 2013;100(6):1695-1703.
- Rubio et al. In vitro fertilization with preimplantation genetic diagnosis for aneuploidies in advanced maternal age: a randomized controlled study. Fertil Steril. 2017 May;107(5):1122-1129.
- Galanello R, Origa R. Beta-thalassemia. Orphanet J Rare Disease. 2010 May 21;5:11.
- Nguyen HN. Thalassemia in Vietnam. Ann Transl Med. 2015;3(s2):ABO35.
- Harper JC, Wilton L, Traeger-Synodinos J, Goossens V, Moutou C, SenGupta SB, Pehlivan-Budak T, Renwick P, De Rycke M, Geraedts JPM, Harton G. The ESHRE PGD Consortium: 10 years of data collection. Hum Reprod Update. 2012 May-Jun;18(3):234-47.











