-
- 1800 2010
- VN
-1366x0.jpg)
Tin chuyên ngành
Array
(
[0] => stdClass Object
(
[id] => 1331
[id_crawler] =>
[category_product] => NULL
[thumbnail] => hcm_images/gentis---Địa-chỉ-giam-định-adn-tại-nha-trang---khanh-hoa-thumb.png
[album] =>
[url_video] =>
[is_status] => 1
[is_featured] => 0
[is_form] => 1
[displayed_time] => 0000-00-00
[program] => 0
[number] => 1
[viewed] => 0
[type] =>
[type_career] =>
[level] =>
[address] =>
[address_career] =>
[expiration_time] => 0000-00-00
[created_time] => 2025-06-16 15:57:50
[updated_time] => 2025-06-23 10:54:40
[files] =>
[salary] =>
[time] =>
[created_by] => 63
[is_table_content] => 1
[language_code] => vi
[slug] => xet-nghiem-adn-tai-nha-trang-gentis-uy-tin-chinh-xac-bao-mat
[title] => Xét Nghiệm ADN Tại Nha Trang | GENTIS - Uy Tín, Chính Xác, Bảo Mật
[description] => Gentis tại Nha Trang nơi làm xét nghiệm ADN huyết thống, trước sinh, pháp lý uy tín chính xác bảo mật với trang thiết bị hiện đại công nghệ tiên tiến chuẩn Quốc tế ISO/ IEC va CAP
[content] => 
Bạn đang tìm kiếm dịch vụ xét nghiệm ADN tại Nha Trang uy tín, chính xác và bảo mật? GENTIS là đơn vị uy tín, cung cấp các gói xét nghiệm ADN huyết thống, ADN trước sinh và ADN pháp lý với độ tin cậy 99,9999%, hỗ trợ thu mẫu tại nhà và trả kết quả nhanh chóng.

1. Các Dịch Vụ Xét Nghiệm ADN Tại Nha Trang

GENTIS cung cấp đa dạng các loại xét nghiệm ADN tại Nha Trang, phục vụ nhiều mục đích khác nhau:
- Xét nghiệm ADN cha/mẹ - con (huyết thống trực hệ)
- Xét nghiệm ADN anh/chị/em
- Xét nghiệm ADN ông/bà - cháu
- Xét nghiệm ADN dòng nội (X, Y TEST) & dòng mẹ (TY THỂ)
- Xét nghiệm ADN trước sinh không xâm lấn (từ tuần thai thứ 8)
- Xét nghiệm ADN pháp lý (khai sinh, nhập tịch, visa, thừa kế,...)
2. Bảng Giá Xét Nghiệm ADN Tại Nha Trang
|
Dịch vụ |
Mẫu thông thường |
Mẫu đặc biệt |
|
Cha/mẹ - con |
3.000.000 VNĐ |
2.500.000 VNĐ/mẫu |
|
Anh/chị/em |
5.000.000 VNĐ |
2.500.000 VNĐ/mẫu |
|
Ông/bà - cháu |
5.000.000 VNĐ |
2.500.000 VNĐ/mẫu |
|
ADN trước sinh |
22.900.000 - 33.000.000 VNĐ |
|
|
ADN pháp lý |
4.500.000 |
???? Giá có thể thay đổi tùy thuộc vào chương trình khuyến mãi cho từng thời điểm. Liên hệ Hotline/Tổng đài để được báo giá ưu đãi.
3. Quy Trình Xét Nghiệm ADN Tại Nha Trang
CTV thu mẫu tận nơi/ lấu mẫu tại chi nhánh/ điểm thu mẫu
.png)
Tự thu mẫu tại nhà:
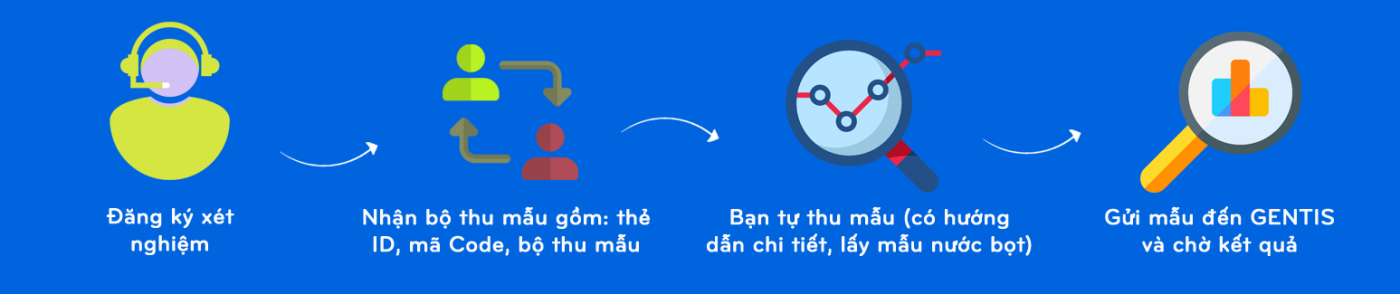
Tư vấn và đăng ký lịch hẹn xét nghiệm qua hotline, website để được hỗ trợ nhanh nhất
Thu mẫu:
- Mẫu máu
- Mẫu niêm mạc miệng (không đau)
- Mẫu tóc nhổ có chân, móng tay/chân, cuống rốn khô,...
- Một số mẫu đặc biệt khác: bàn chải đánh răng, dịch quần lót, đầu lọc thuốc lá,...
Phân tích tại phòng lab:
- Hệ thống máy móc trang thiết bị hiện đại
- Quy trình chuẩn quốc tế ISO/IEC, CAP
Nhận kết quả:
- Thời gian: 1-3 ngày (tiêu chuẩn) hoặc 6h-24h (có phí bổ sung)
- Hình thức: Bản mềm qua email hoặc bản cứng có dấu đỏ gửi chuyển phát nhanh
4. Các trường hợp xét nghiệm ADN
- Cha/mẹ muốn xác nhận quan hệ với con (giải quyết tranh chấp, làm giấy tờ).
- Gia đình muốn kiểm tra huyết thống (anh/chị/em, ông/bà - cháu).
- Phụ nữ mang thai muốn xét nghiệm ADN trước sinh.
- Người cần làm thủ tục pháp lý (nhập tịch, thừa kế, visa).
5. Liên Hệ Đặt Lịch Xét Nghiệm ADN Tại Nha Trang

- Địa chỉ: Liên hệ Hotline/Tổng đài để được hướng dẫn điểm thu mẫu gần nhất
- Hotline: 0833.20.2929
- Tổng đài: 1800 2010
- Website: gentis.vn, gentis.com.vn
Bạn đang cần xét nghiệm ADN để xác minh huyết thống, nhận cha – con, hoặc vì lý do pháp lý tại Quảng Ngãi? Trung tâm Gentis – đơn vị với 15 năm kin nghiệm trong lĩnh vực xét nghiệm gen tại Việt Nam – nay đã có mặt tại Quảng Ngãi, mang đến dịch vụ xét nghiệm ADN uy tín, bảo mật và đạt chuẩn quốc tế.

Vì sao nên chọn dịch vụ xét nghiệm ADN Gentis tại Quảng Ngãi?
.jpg)
1. Độ chính xác cao lên đến 99.9999%
Gentis sử dụng công nghệ phân tích ADN tiên tiến, đạt chuẩn quốc tế ISO 9001:2015 và ISO 15189:2012. Kết quả xét nghiệm có độ chính xác gần như tuyệt đối, được công nhận cả trong nước lẫn quốc tế.
2. Dịch vụ đa dạng:
.png)
- Xét nghiệm ADN huyết thống (cha – con, mẹ – con, anh chị em, ông bà – cháu…)
- Xét nghiệm ADN hành chính (làm giấy khai sinh, nhận con, định cư nước ngoài)
- Xét nghiệm ADN cá nhân, thai nhi
- Xét nghiệm ADN huyết thống từ mẫu đặc biệt (đầu lọc thuốc lá, bàn chải đánh răng,...)
3. Lấy mẫu tận nơi tại Quảng Ngãi
Gentis có đội ngũ nhân viên hỗ trợ lấy mẫu tận nhà, tận nơi làm việc tại Quảng Ngãi, nhanh chóng, tiện lợi và bảo mật tuyệt đối.
.png)
Tự thu mẫu tại nhà:

4. Thời gian trả kết quả nhanh
Tùy gói dịch vụ, kết quả có thể trả sau 1 – 2 ngày làm việc. Có cả hình thức trả kết quả bản mềm và bản cứng.
5. Bảo mật thông tin tuyệt đối
Mọi thông tin cá nhân, kết quả xét nghiệm của khách hàng đều được mã hóa và bảo mật theo tiêu chuẩn y tế quốc tế.
Bảng giá xét nghiệm ADN tại GENTIS Quảng Ngãi (tham khảo)
Xét nghiệm ADN cha/mẹ - con:
- Mẫu máu/mẫu niêm mạc miệng: Từ 3.000.000/2 mẫu (tùy số lượng mẫu và thời gian trả kết quả).
- Mẫu đặc biệt (đầu lọc thuốc lá, bàn chải đánh răng,…): Từ 4.000.000/mẫu.
Xét nghiệm ADN huyết thống khác:
- Xét nghiệm ADN dòng nội (trên NST X hoặc NST Y) hoặc dòng mẹ (Ty thể): Từ 5.000.000/2 mẫu.
Xét nghiệm ADN trước sinh (không xâm lấn):
- Từ tuần thai thứ 8+: Khoảng 22.900.00/xét nghiệm.
Thời gian trả kết quả:
- Tiêu chuẩn: 1-2 ngày (gói sau sinh), 14 ngày (gói trước sinh).
- Nhanh (24h hoặc 6h): Phát sinh thêm chi phí so với gói thường.
Địa chỉ liên hệ Gentis tại Quảng Ngãi
Hiện tại, Gentis chưa có phòng xét nghiệm trực tiếp tại Quảng Ngãi nhưng có hỗ trợ tư vấn và lấy mẫu tại nhà qua hệ thống chi nhánh và đối tác. Để được hỗ trợ tốt nhất, bạn có thể:
- Gọi tổng đài 1800 2010 (miễn phí cước)
- Truy cập website chính thức: gentis.com.vn, gentis.vn
- Hoặc đăng ký trực tuyến để được lấy mẫu xét nghiệm ADN tại Quảng Ngãi.
Lưu ý khi xét nghiệm ADN tại Quảng Ngãi:
- Không cần nhịn ăn, không cần chuẩn bị gì phức tạp trước khi lấy mẫu.
- Có thể sử dụng nhiều loại mẫu khác nhau (máu, niêm mạc miệng, móng tay, tóc có chân, máu khô…)
- Quý khách nên mang theo giấy tờ tùy thân nếu cần dùng kết quả cho mục đích pháp lý.
Đánh giá của khách hàng tại Quảng Ngãi về Gentis:
“Tôi ở TP Quảng Ngãi, cần xét nghiệm ADN để làm thủ tục nhận con. Nhân viên Gentis đến tận nơi lấy mẫu, tư vấn rất tận tình, kết quả có sau 2 ngày, rất đáng tin cậy.” – Anh Hoàng, 38 tuổi.
“Tôi đã từng xét nghiệm tại một số nơi, nhưng Gentis là nơi tôi thấy chuyên nghiệp và bảo mật nhất. Rất hài lòng!” – Chị Trang, huyện Bình Sơn.
Liên hệ ngay để xét nghiệm ADN tại Quảng Ngãi với Gentis

- Hotline: 0833202929
- Tổng đài: 1800 2010 (tư vấn miễn phí cước gọi 24/7)
- Website: gentis.com.vn, gentis.vn
- Dịch vụ xét nghiệm ADN Gentis tại Quảng Ngãi – chính xác, nhanh chóng và bảo mật hàng đầu.

Nhu cầu xét nghiệm ADN ngày càng tăng cao tại Vũng Tàu, phục vụ các mục đích như xác định huyết thống, làm giấy khai sinh, nhập tịch, hay hỗ trợ pháp lý. Trong đó, GENTIS là đơn vị hàng đầu cung cấp dịch vụ xét nghiệm ADN chính xác, bảo mật và nhanh chóng.

Gentis là lựa chọn hàng đầu với quy trình chuyên nghiệp, công nghệ hiện đại và kết quả chính xác cao
Địa chỉ và Thời gian làm việc
- Địa chỉ: Liên hệ Hotline 0888 40 2010 để được tư vấn điểm lấy mẫu gần nhất
- Giờ làm việc: 8h00 – 17h00, từ Thứ 2 đến Chủ Nhật
Dịch vụ xét nghiệm ADN tại Gentis Vũng Tàu

- Gentis cung cấp đa dạng dịch vụ xét nghiệm ADN, bao gồm:
- Xét nghiệm huyết thống: cha con, mẹ con, anh chị em, ông bà – cháu
- Xét nghiệm hành chính: làm giấy khai sinh, xác nhận quan hệ thừa kế, cấp dưỡng khi ly hôn
- Xét nghiệm pháp lý: liên quan đến kiện tụng, nhập tịch, định cư
- Xét nghiệm gen bệnh lý: Tan máu bẩm sinh Thalassemia, gen bệnh lý di truyền khác,...
Công nghệ và Chất lượng
- Phòng xét nghiệm đạt chuẩn ISO 15189:2012 và ISO 9001:2015, ISO/IEC 17025
- Chứng nhận CAP (College of American Pathologists) CAP là tổ chức kiểm định phòng xét nghiệm hàng đầu thế giới, đặc biệt trong lĩnh vực xét nghiệm y khoa và ADN.
- Áp dụng công nghệ Giải trình tự gen thế hệ mới (Next-Generation Sequencing - NGS) của Illumina (Mỹ) và Thermo Fisher (Mỹ)
- Sử dụng bộ KIT chuyên dụng cho xét nghiệm ADN hình sự từ Promega (Mỹ) và Qiagen (Đức)
- Quy trình xét nghiệm tuân thủ hướng dẫn của FBI Mỹ, đảm bảo độ chính xác lên đến 99.9%
Chi phí và Ưu đãi
Gentis cung cấp nhiều gói dịch vụ với mức giá cạnh tranh:
- Xét nghiệm ADN tự nguyện: từ 1.500.000 VNĐ/mẫu
- Xét nghiệm ADN hành chính: từ 2.250.000 VNĐ/mẫu
- Xét nghiệm ADN thai nhi không xâm lấn: 22.900.000 VNĐ
Quy trình và Hình thức thực hiện
Tại điểm thu mẫu Vũng Tàu:
.png)
- Đến trực tiếp địa chỉ Gentis tại Vũng Tàu để được tư vấn và điền đơn đăng ký xét nghiệm
- Nhân viên Gentis hỗ trợ thu mẫu nhanh chóng
- Kết quả được gửi tận nhà qua chuyển phát nhanh hoặc email, tùy theo yêu cầu
- Địa chỉ văn phòng Gentis Vũng Tàu: Liên hệ Hotline 0888 40 2010 để được tư vấn điểm lấy mẫu gần nhất
Tự thu mẫu tại nhà:

- Thu thập mẫu như máu, niêm mạc miệng, tóc có chân, móng tay/chân, tàn thuốc lá, kẹo cao su, v.v.
- Ghi rõ tên từng người trên phong bì và gửi về phòng Lab Gentis tại TP.HCM: 8/24 Nguyễn Đình Khơi, Phường 4, Quận Tân Bình, TP.HCM
- Kết quả được gửi về theo hình thức đã đăng ký
Thu mẫu tận nơi:
- Gentis hỗ trợ thu mẫu tận nơi miễn phí cho khách hàng đăng ký qua hotline 0888402010 và tổng đài miễn phí 1800 2010
Lý do chọn Gentis Vũng Tàu
- Đơn vị tiên phong trong lĩnh vực xét nghiệm ADN tại Việt Nam
- Kết quả chính xác, được các cơ quan nhà nước và Đại sứ quán công nhận
- Quy trình nhanh chóng, bảo mật thông tin tuyệt đối
- Hỗ trợ thu mẫu tận nơi, tiện lợi cho khách hàng
- Đội ngũ thu mẫu tận nơi, nhanh, tác phong chuyên nghiệp
Liên hệ và Đặt lịch
- Hotline: 0833202929
- Tổng đài miễn phí: 1800 2010
- Website: gentis.com.vn, gentis.vn

Nhu cầu xét nghiệm ADN ở Đà Lạt ngày càng tăng cao, phục vụ cho mục đích xác định huyết thống, làm giấy khai sinh, nhập tịch. GENTIS là đơn vị uy tín với 15 năm kinh nghiệm trong ngành, cung cấp dịch vụ xét nghiệm ADN chính xác, bảo mật và nhanh chóng tại Đà Lạt.

1. Dịch Vụ Xét Nghiệm ADN GENTIS
.jpg)
GENTIS cung cấp đa dạng các loại xét nghiệm ADN tại Đà Lạt, bao gồm:
- Xét nghiệm ADN cha/mẹ - con (huyết thống trực hệ)
- Xét nghiệm ADN anh/chị/em (huyết thống không trực hệ)
- Xét nghiệm ADN dòng nội (X, Y TEST) & dòng mẹ (TY THỂ)
- Xét nghiệm ADN trước sinh không xâm lấn (từ tuần thai thứ 8)
- Xét nghiệm ADN pháp lý (khai sinh, visa, nhập tịch, thừa kế,...)
2. Quy Trình Xét Nghiệm ADN Tại GENTIS
Quy trình xét nghiệm tại Gentis/ chi nhánh/ điểm thu mẫu
.png)
Quy trình xét nghiệm tự thu mẫu tại nhà

Bước 1: Thu mẫu
- Mẫu phổ biến: máu, niêm mạc miệng, tóc nhổ, móng tay/móng chân, cuống rốn,…
- Mẫu đặc biệt: bàn chải đánh răng, dịch quần lót, đầu lọc thuốc lá,...
- Mẫu do nhân viên thu mẫu trực tiếp thu hoặc khách hàng tự thu mẫu gửi đến
Bước 2: Phân tích ADN
- Mẫu được gửi về phòng Lab hiện đại đạt chuẩn ISO 9001:2015
- Sử dụng công nghệ giải trình tự gen thế hệ mới
Bước 3: Nhận kết quả
- Thời gian trả kết quả:
- Tiêu chuẩn: 1-3 ngày
- Nhanh: 6h hoặc 24h (có phí bổ sung)
- Kết quả được bảo mật tuyệt đối, gửi qua email, bản cứng,…
3. Bảng Giá Xét Nghiệm ADN Tại GENTIS Đà Lạt
|
Dịch vụ |
Mẫu thông thường |
Mẫu đặc biệt |
|
Cha/mẹ - con |
3.000.000 VNĐ |
Thêm 2.500.000 VNĐ/mẫu |
|
Anh/chị/em |
5.000.000 VNĐ |
Thêm 2.500.000 VNĐ/mẫu |
|
Ông/bà - cháu |
5.000.000 VNĐ |
Thêm 2.500.000 VNĐ/mẫu |
|
ADN trước sinh |
22.900.000 - 33.000.000 VNĐ |
|
|
ADN pháp lý |
Từ 4.500.000 |
???? Giá có thể thay đổi tùy thuộc vào chương trình khuyến mãi cho từng thời điểm. Liên hệ Hotline/Tổng đài để được báo giá ưu đãi.
4. Tại Sao Nên Chọn GENTIS Đà Lạt?
.jpg)
- Độ chính xác 99,9999%
- Bảo mật thông tin – Cam kết không tiết lộ thông tin khách hàng
5. Liên Hệ Đặt Lịch Xét Nghiệm ADN Tại Đà Lạt
- Địa chỉ: Liên hệ Hotline/Tổng đài để được hướng dẫn điểm thu mẫu gần nhất
- Hotline: 0833202929
- Tổng đài: 1800 2010
- Website: gentis.vn, gentis.com.vn
6. Hướng dẫn Khách hàng tại Đà Lạt làm xét nghiệm ADN
- Đặt lịch lấy mẫu tại nhà hoặc tại điểm hẹn địa phương
GENTIS hỗ trợ lấy mẫu tận nơi thông qua đội ngũ cộng tác viên. Bạn chỉ cần liên hệ trước, nhân viên sẽ đến tận nhà, nơi làm việc hoặc điểm thuận tiện tại Đà Lạt để lấy mẫu
- Gửi mẫu về Trung tâm
Mẫu sau khi lấy sẽ được gửi về Trung tâm GENTIS HCM tại 8/24 Nguyễn Đình Khơi, Phường 4, Quận Tân Bình, TP.HCM) để phân tích và trả kết quả theo thời gian đã thỏa thuận
GENTIS Đà Lạt – Địa chỉ xét nghiệm ADN uy tín, nhanh chóng, độ chính xác cao!
[content_more] => [meta_title] => Xét Nghiệm ADN Ở Đà Lạt | GENTIS - Độ Chính Xác Cao, Bảo Mật Tuyệt Đối [meta_description] => Gentis địa chỉ xét nghiệm ADN tại Đà Lạt - Lâm Đồng chính xác bảo mật tiết kiệm. Thủ tục đơn giản thời gian trả kết quả nhanh, có tính pháp lý cao [meta_keyword] => Đà Lạt,Lâm Đồng,Xét nghiệm ADN [thumbnail_alt] => Xét Nghiệm ADN Ở Đà Lạt Địa chỉ tại GENTIS - Độ Chính Xác Cao, Bảo Mật Tuyệt Đối [post_id] => 1328 [category_id] => 15 ) [4] => stdClass Object ( [id] => 1325 [id_crawler] => [category_product] => NULL [thumbnail] => hcm_images/adn-cần-thơ-thumb.png [album] => [url_video] => [is_status] => 1 [is_featured] => 0 [is_form] => 1 [displayed_time] => 0000-00-00 [program] => 0 [number] => 1 [viewed] => 0 [type] => [type_career] => [level] => [address] => [address_career] => [expiration_time] => 0000-00-00 [created_time] => 2025-06-13 15:39:08 [updated_time] => 2025-06-23 10:56:57 [files] => [salary] => [time] => [created_by] => 63 [is_table_content] => 1 [language_code] => vi [slug] => xet-nghiem-adn-tai-can-tho-uy-tin-chinh-xac-bao-mat-gentis [title] => Xét Nghiệm ADN Cần Thơ tại Gentis: Uy Tín, Chính Xác, Bảo Mật [description] => Xét nghiệm ADN tại Gentis Cần Thơ cần chính xác, bảo mật thông tin có tính pháp lý cao. Gentis - chuyên giám định ADN huyết thống cha mẹ - con, họ hàng nội ngoại, ADN trước sinh, hành chính khai sinh [content] =>
Bạn đang tìm kiếm dịch vụ xét nghiệm ADN tại Cần Thơ uy tín, chính xác và bảo mật? GENTIS tự hào là đơn vị hàng đầu Việt Nam cung cấp các giải pháp phân tích ADN với công nghệ tiên tiến, kết quả nhanh chóng và độ tin cậy cao.

Tại Sao Chọn Xét Nghiệm ADN Tại GENTIS Cần Thơ?
.jpg)
- Độ chính xác 99,9999%: Sử dụng công nghệ giải trình tự gen thế hệ mới, đạt tiêu chuẩn quốc tế.
- Bảo mật tuyệt đối: Thông tin khách hàng được mã hóa, chỉ trả kết quả trực tiếp cho người đứng đơn yêu cầu xét nghiệm.
- Xét nghiệm đa dạng: ADN huyết thống, xác định quan hệ gia đình, làm giấy khai sinh, nhập tịch, di truyền.
- Thời gian trả kết quả nhanh: Từ 6-24 giờ (tùy dịch vụ), hỗ trợ trả kết quả online.
- Thu mẫu đơn giản: Mẫu máu, niêm mạc miệng, tóc, móng tay… thuận tiện cho mọi đối tượng.
Các Dịch Vụ Xét Nghiệm ADN Tại GENTIS Cần Thơ
.png)
- Xét nghiệm ADN cha con, mẹ con
- Xét nghiệm ADN họ hàng (ông/bà - cháu, anh/chị - em)
- Xét nghiệm ADN làm giấy khai sinh, nhập tịch
- Xét nghiệm ADN trước sinh không xâm lấn
- Xét nghiệm gen di truyền (Tan máu bẩm sinh,…)
Quy Trình Xét Nghiệm ADN Tại GENTIS Cần Thơ
Quy trình xét nghiệm ADN cho Khách hàng đến trực tiếp chi nhánh/ điểm thu mẫu Cần Thơ
.png)
Quy trình xét nghiệm ADN áp dụng cho Khách hàng tự thu mẫu tại nhà và gửi mẫu về trung tâm Gentis

- Đăng ký dịch vụ: Liên hệ Hotline hoặc đến trực tiếp trung tâm.
- Thu mẫu: Lấy mẫu máu, niêm mạc miệng hoặc các mẫu khác theo yêu cầu.
- Phân tích tại phòng lab hiện đại: Mẫu được kiểm tra bằng công nghệ cao.
- Nhận kết quả: Trả kết quả sau 1-7 ngày (có dịch vụ nhanh 6-24 giờ).
Tự thu mẫu tại nhà
Bảng Giá Xét Nghiệm ADN Tại Cần Thơ
Đây là bảng giá xét nghiệm ADN niêm yết chưa áp dụng giảm giá/ khuyến mãi/ chương trình ưu đãi chỉ để tham khảo, khách hàng làm xét nghiệm ADN liên hệ hotline: 0888402010 để biết chi tiết và chính xác.
|
Dịch vụ |
Mẫu xét nghiệm |
Thời gian trả kết quả |
Giá tham khảo |
|
ADN cha/mẹ - con |
Máu, niêm mạc miệng, tóc, móng… |
1-2 ngày |
Từ 3.000.000đ |
|
ADN làm giấy khai sinh |
Máu, niêm mạc miệng |
2 ngày |
Từ 4.500.000đ |
|
ADN trước sinh |
Máu thai phụ và mẫu Cha giả định |
7-10 ngày |
Từ 22.900.000đ |
|
ADN anh/chị/em |
Máu, niêm mạc miệng, tóc, móng… |
1-3 ngày |
Từ 5.000.000đ |
Thời gian trả kết quả tính từ khi mẫu được nhận tại Phòng xét nghiệm Gentis HCM
Địa Chỉ Xét Nghiệm ADN Uy Tín Tại Cần Thơ
Quý khách hàng tại Cần Thơ làm xét nghiệm ADN có thể tự thu mẫu tại nhà rồi gửi về Trung tâm Gentis TpHCM, hoặc liên hệ trực tiếp Hotline: 0888402010 để biết chính xác điểm thu mẫu gần nhất hoặc đặt lịch hẹn Cộng tác viên của Gentis sẽ đến tận nhà lấy mẫu
Trung tâm GENTIS Cần Thơ
- Địa chỉ: Liên hệ Hotline 0888402010 để biết vị trí lấy mẫu gần nhất
- ☎ Hotline: 0833202929 - Tổng đài miễn phí: 18002010
- Website: gentis.vn, gentis.com.vn
Đặt lịch ngay hôm nay để nhận tư vấn miễn phí!
Cam Kết Của GENTIS

- Kết quả chính xác 99,9999%, đảm bảo pháp lý.
- Hỗ trợ tư vấn 24/7 bởi đội ngũ chuyên gia.
- Bảo hành dịch vụ, đền bù nếu sai sót.
GENTIS Cần Thơ - Nơi trao gửi niềm tin! Liên hệ ngay để được hỗ trợ nhanh nhất!
[content_more] => [meta_title] => Xét Nghiệm ADN Tại Cần Thơ tai Gentis Uy Tín, Chính Xác, Bảo Mật [meta_description] => Xét nghiệm ADN tại Cần Thơ cần chính xác, bảo mật thông tin có tính pháp lý. Gentis - chuyên giám định ADN huyết thống, ADN trước sinh, hành chính. [meta_keyword] => xét nghiệm ADN,Cần Thơ [thumbnail_alt] => Xét nghiệm ADN Cần Thơ chính xác bảo mật chi phí thấp [post_id] => 1325 [category_id] => 15 ) [5] => stdClass Object ( [id] => 1324 [id_crawler] => [category_product] => NULL [thumbnail] => hcm_images/adn-Đồng-nai.png [album] => [url_video] => [is_status] => 1 [is_featured] => 0 [is_form] => 1 [displayed_time] => 2025-06-06 [program] => 0 [number] => 1 [viewed] => 0 [type] => [type_career] => [level] => [address] => [address_career] => [expiration_time] => 0000-00-00 [created_time] => 2025-06-13 13:59:45 [updated_time] => 2025-06-23 10:57:18 [files] => [salary] => [time] => [created_by] => 63 [is_table_content] => 1 [language_code] => vi [slug] => xet-nghiem-adn-tai-dong-nai-dich-vu-uy-tin-chinh-xac-tu-gentis [title] => Xét Nghiệm ADN Tại Đồng Nai - Uy tín Bảo mật & Chính Xác Từ GENTIS [description] => Xét nghiệm ADN Đồng Nai tại Gentis - nơi giám định ADN huyết thống cha con, hành chính, khai sinh rất uy tín, chính xác bảo mật thông tin [content] =>
Giới Thiệu Dịch Vụ Xét Nghiệm ADN Tại Đồng Nai
Nhu cầu xét nghiệm ADN tại Đồng Nai ngày càng tăng cao với nhiều mục đích khác nhau như:
- Xác định quan hệ huyết thống cha-con, mẹ-con
- Làm thủ tục pháp lý (giấy khai sinh, nhập tịch, visa)
- Xét nghiệm ADN trước sinh
GENTIS tự hào là đơn vị xét nghiệm uy tín, cung cấp dịch vụ xét nghiệm ADN chính xác, bảo mật và nhanh chóng tại Đồng Nai.

Các xét nghiệm ADN tại GENTIS Đồng Nai:
1. Xét Nghiệm Huyết Thống
- Cha/mẹ - con
- Ông bà - cháu
- Anh chị em
- Xét nghiệm họ hàng
.png)
.jpg)
2. Xét Nghiệm ADN Pháp Lý
- Làm giấy khai sinh
- Nhập tịch, xin visa, định cư nước ngoài
- Giải quyết tranh chấp thừa kế
3. Xét Nghiệm ADN Trước Sinh
- Có thể thực hiện từ tuần thai thứ 8
- Xét nghiệm theo phương pháp không xâm lấn, thu mẫu máu tĩnh mạch thai phụ
- An toàn tuyệt đối cho mẹ và bé
- Độ chính xác lên đến 99.9%
4. Quy Trình Xét Nghiệm ADN Tại GENTIS Đồng Nai
Tư vấn và đăng ký lịch hẹn xét nghiệm qua hotline, website để được hỗ trợ nhanh nhất
Lấy mẫu chi nhánh Gentis/ điểm thu mẫu
.png)
Tự thu mẫu tại nhà:

Thu mẫu:
- Mẫu máu
- Mẫu niêm mạc miệng (không đau)
- Mẫu tóc nhổ có chân, móng tay/chân, cuống rốn khô,...
- Một số mẫu đặc biệt khác: bàn chải đánh răng, dịch quần lót, đầu lọc thuốc lá,...
Phân tích tại phòng lab:
- Hệ thống máy móc trang thiết bị hiện đại
- Quy trình chuẩn quốc tế ISO/IEC, CAP
Nhận kết quả:
- Thời gian: 1-3 ngày (tiêu chuẩn) hoặc 6h-24h (có phí bổ sung)
- Hình thức: Bản mềm qua email hoặc bản cứng có dấu đỏ
5. Ưu Điểm Khi Xét Nghiệm ADN Tại GENTIS Đồng Nai
- Phòng lab đạt chuẩn quốc tế ISO 9001:2015, ISO 15189:2012 và CAP (Mỹ)
- Công nghệ giải trình tự gen thế hệ mới
- Độ chính xác lên đến 99.9999%
- Bảo mật thông tin tuyệt đối
- Dịch vụ thu mẫu tại nhà
- Hỗ trợ 24/7 qua Hotline 0888402010 hoặc Tổng đài miễn phí 1800 2010
6. Bảng Giá Xét Nghiệm ADN Tại Đồng Nai
Đây là bảng giá niêm yết tham khảo của Gentis TpHCM, bảng giá này chưa áp dụng Khuyến mãi/ Chương trình ưu đãi, Quý Khách hàng liên hệ hotline để biết chi tiết và chính xác nhất!
|
Dịch vụ |
Mẫu thông thường |
Mẫu đặc biệt |
|
Cha/mẹ - con |
3.000.000 VNĐ |
Thêm 2.500.000 VNĐ/mẫu |
|
Anh/chị/em |
5.000.000 VNĐ |
Thêm 2.500.000 VNĐ/mẫu |
|
Ông/bà - cháu |
5.000.000 VNĐ |
Thêm 2.500.000 VNĐ/mẫu |
|
ADN trước sinh |
22.900.000 - 33.000.000 VNĐ |
|
|
ADN pháp lý |
4.500.000 VNĐ |
???? Giá có thể thay đổi tùy thuộc vào chương trình khuyến mãi cho từng thời điểm. Liên hệ Hotline/Tổng đài để được báo giá ưu đãi.
7. Địa Chỉ Xét Nghiệm ADN Uy Tín Tại Đồng Nai
- Địa chỉ: Liên hệ Hotline/Tổng đài để được hướng dẫn điểm thu mẫu gần nhất
- Hotline: 0833202929
- Tổng đài: 1800 2010
- Website: https://gentis.vn, gentis.com.vn
8. Câu Hỏi Thường Gặp
❓ Xét nghiệm ADN có đau không?
→ Không đau, chỉ cần lấy mẫu niêm mạc miệng hoặc 1-2 giọt máu đầu ngón tay.
❓ Có cần giấy tờ tùy thân khi làm xét nghiệm?
→ Chỉ cần khi làm xét nghiệm pháp lý (CCCD, giấy khai sinh, hộ chiếu,...).
❓ Có thể lấy mẫu tại nhà không?
→ Có, GENTIS hỗ trợ dịch vụ thu mẫu tận nơi.
GENTIS tự hào là đơn vị xét nghiệm ADN uy tín tại Đồng Nai với:

- Đội ngũ chuyên gia giàu kinh nghiệm
- Trang thiết bị hiện đại
- Dịch vụ chuyên nghiệp
- Bảo mật tuyệt đối
Liên hệ ngay với GENTIS Đồng Nai để được tư vấn miễn phí!

Nhu cầu xét nghiệm ADN tại Bình Dương ngày càng tăng, phục vụ mục đích xác định huyết thống, làm giấy khai sinh, nhập tịch, thủ tục pháp lý hoặc kiểm tra sức khỏe di truyền. Trong đó, GENTIS là đơn vị hàng đầu cung cấp dịch vụ xét nghiệm ADN uy tín, chính xác và bảo mật.

.jpg)
1. Xét Nghiệm ADN Là Gì? Ứng Dụng Thực Tế
Xét nghiệm ADN là phương pháp phân tích vật chất di truyền (ADN) để xác định mối quan hệ huyết thống, chẩn đoán bệnh di truyền hoặc ứng dụng trong pháp y.
Các Loại Xét Nghiệm ADN Phổ Biến
- Xét nghiệm ADN cha-con/mẹ-con (xác định quan hệ huyết thống)
- Xét nghiệm ADN họ hàng (anh chị em, ông bà - cháu)
- Xét nghiệm ADN làm giấy khai sinh, nhập tịch (đủ pháp lý)
- Xét nghiệm ADN trước sinh không xâm lấn (an toàn cho mẹ và bé)
2. Dịch Vụ Xét Nghiệm ADN Tại Bình Dương Của GENTIS
.png)
GENTIS là đơn vị tiên phong trong lĩnh vực phân tích di truyền tại Việt Nam, với:
- Phòng LAB đạt chuẩn quốc tế ISO 9001:2015 & CAP (Mỹ)
- Công nghệ giải trình tự gen thế hệ mới (NGS)
- Kết quả chính xác 99,9999%, có giá trị pháp lý
- Bảo mật thông tin tuyệt đối
- Hỗ trợ thu mẫu tại nhà, trả kết quả nhanh
Quy Trình Xét Nghiệm ADN Tại GENTIS Bình Dương
- Đăng ký dịch vụ – Online hoặc trực tiếp tại điểm thu mẫu.
- Thu mẫu – Mẫu máu, niêm mạc miệng, tóc, móng tay… (không đau).
- Phân tích tại phòng lab hiện đại – đảm bảo độ chính xác cao.
- Nhận kết quả – trả nhanh từ 6 - 24 giờ hoặc tiêu chuẩn 1-3 ngày (tùy loại xét nghiệm).
Lấy mẫu tại chi nhánh/ điểm thu mẫu Bình Dương
.png)
Khách hàng đến chi nhánh Gentis Bình Dương hoặc điểm thu mẫu tại Bình Dương lấy mẫu, hoặc CTV/ nhân viên thu mẫu Gentis Bình Dương đến tại nhà trực tiếp lấy mẫu theo quy định, thủ tục của Gentis.
Trường hợp nhân viên/ CTV đến tại nah thu mẫu sẽ phát sinh phụ phí tuỳ vào vị trí địa chỉ Khách hàng sẽ có mức phụ thu phí di chuyển phù hợp khoản cách.
Tự thu mẫu tại nhà

Trường hợp Khách hàng tự thu mẫu tại nhà, chuyên viên Gentis sẽ hưỡng dẫn đảm bảo yêu cầu trong lúc lấy mẫu, bảo quản và gửi về Gentis HCM: 8/24 Nguyễn Đình KHơi, P4, Tân Bình, HCM, để đảm bảo mẫu không bị lẫn tập chất, hạn chế trong quá trình phân tích bị sai lệch kết quả.
3. Đối tượng cần xét nghiệm ADN tại Bình Dương
3.1 Các cá nhân nghi ngờ quan hệ huyết thống
- Cha mẹ muốn xác nhận quan hệ huyết thống với con cái (cha con, mẹ con).
- Anh chị em ruột cần chứng minh mối quan hệ huyết thống.
- Ông bà, cháu muốn xác minh quan hệ huyết thống trong gia đình.
- Các cá nhân nghi ngờ huyết thống để giải quyết các tranh chấp, thừa kế hoặc các vấn đề cá nhân.
3.2 Các cặp vợ chồng hoặc phụ nữ mang thai
- Cần xét nghiệm ADN thai nhi không xâm lấn để xác định cha con khi còn ở thai nhi, giải tỏa nghi ngờ trong gia đình.
3.3. Người cần xét nghiệm ADN phục vụ mục đích pháp lý
- Xác minh quan hệ huyết thống để làm giấy khai sinh, xác nhận thừa kế, ly hôn, cấp dưỡng.
- Người tham gia tranh chấp pháp lý liên quan đến quyền lợi gia đình.
- Người xin nhập tịch, định cư cần chứng minh quan hệ huyết thống theo yêu cầu của cơ quan chức năng.
3.4. Người nghi ngờ hoặc muốn sàng lọc các bệnh lý di truyền
- Gia đình có tiền sử bệnh di truyền như tan máu bẩm sinh (Thalassemia)...
- Người muốn kiểm tra các gen liên quan đến sức khỏe và dự phòng bệnh lý.
3.5. Các cơ quan, tổ chức pháp lý và tư pháp tại Bình Dương
- Yêu cầu xét nghiệm ADN phục vụ điều tra hình sự, giải quyết tranh chấp pháp lý.
- Xác minh danh tính trong các vụ án, tranh chấp.
4. Bảng Giá Xét Nghiệm ADN Tại Bình Dương
Đây là bảng giá xét nghiệm ADN niêm yết chưa áp dụng giảm giá/ khuyến mãi/ chương trình Ưu đãi chỉ để tham khảo, khách hàng làm xét nghiệm ADN liên hệ hotline để biết chi tiết và chính xác.
- Cha/mẹ - con: từ 3.000.000
- Anh/chị em: từ 5.000.000
- ADN trước sinh không xâm lấn: từ 22.900.000
- Xét nghiệm gen di truyền: từ 1.200.000
(Giá có thể thay đổi, liên hệ GENTIS để nhận báo giá và chương trình ưu đãi tốt nhất)
5. Địa Chỉ Xét Nghiệm ADN Uy Tín Tại Bình Dương

GENTIS Bình Dương
- Địa chỉ: Liên hệ Hotline/Tổng đài Gentis để được hướng dẫn đến địa chỉ đại lý gần nhất
- Hotline: 0833202929
- Tổng đài miễn phí: 18002010
- Website: gentis.vn
Nếu bạn đang tìm địa chỉ xét nghiệm ADN uy tín tại Bình Dương, GENTIS là lựa chọn hàng đầu với độ chính xác cao, bảo mật và hỗ trợ pháp lý đầy đủ. Liên hệ ngay để được tư vấn miễn phí!
[content_more] => [meta_title] => Xét nghiệm ADN Bình Dương - Xét nghiệm huyết thống chính xác, bảo mật [meta_description] => Xét nghiệm ADN tại Bình Dương - Xét nghiệm ADN huyết thống, hành chính chính xác 99.99%, bảo mật thông tin. Phòng Lab đạt chuẩn Quốc tế ISO/ IEC/ CAP. [meta_keyword] => xét nghiệm ADN,Bình Dương,Dĩ An,Thuận An,Thủ Dầu Một [thumbnail_alt] => Xét nghiệm ADN Bình Dương - Xét nghiệm huyết thống hành chính chính xác, bảo mật [post_id] => 1323 [category_id] => 15 ) [7] => stdClass Object ( [id] => 1322 [id_crawler] => [category_product] => NULL [thumbnail] => hcm_images/giam-định-adn-hcm.png [album] => [url_video] => [is_status] => 1 [is_featured] => 0 [is_form] => 1 [displayed_time] => 2025-06-06 [program] => 0 [number] => 1 [viewed] => 0 [type] => [type_career] => [level] => [address] => [address_career] => [expiration_time] => 0000-00-00 [created_time] => 2025-06-13 11:01:09 [updated_time] => 2025-06-23 10:58:16 [files] => [salary] => [time] => [created_by] => 63 [is_table_content] => 1 [language_code] => vi [slug] => xet-nghiem-adn-tphcm-gentis-chinh-xac-999999-bao-mat-tuyet-doi [title] => Xét Nghiệm ADN TP.HCM | GENTIS - Chính Xác 99,9%, Bảo Mật Tuyệt Đối [description] => Xét nghiệm ADN TpHCM uy tín chính xác - xét nghiệm ADN huyết thống, hành chính, khai sinh. Phòng xét nghiệm ADN đạt chuẩn Quốc tế ISO/ IEC/ CAP [content] =>

Bạn đang tìm địa chỉ xét nghiệm ADN tại TP.HCM uy tín, chính xác? GENTIS tự hào là đơn vị dẫn đầu tại Việt Nam với:
- Với 15 năm kinh nghiệm trong lĩnh vực phân tích di truyền
- Phòng lab đạt chuẩn quốc tế ISO 9001:2015 & CAP
- Độ chính xác 99,9999% được công nhận toàn cầu
- Dịch vụ trọn gói từ thu mẫu tại nhà đến trả kết quả pháp lý
.png)
.jpg)
1. Các Dịch Vụ Xét Nghiệm ADN Tại TP.HCM
- Xét nghiệm ADN cha-con/mẹ-con (xác định quan hệ huyết thống)
- Xét nghiệm ADN họ hàng (anh chị em, ông bà - cháu)
- Xét nghiệm ADN làm giấy khai sinh, nhập tịch (đủ pháp lý)
- Xét nghiệm ADN trước sinh không xâm lấn (an toàn cho mẹ và bé)
.png)
2. Các Đối Tượng Nên Làm Xét Nghiệm ADN Tại GENTIS
2.1. Xác Định Quan Hệ Huyết Thống
- Cha/mẹ nghi ngờ quan hệ với con: Giải tỏa nghi ngờ, làm thủ tục pháp lý
- Con nuôi muốn tìm cha mẹ ruột: Xác minh nguồn gốc
- Anh/chị em nghi ngờ cùng cha/mẹ: Kiểm tra quan hệ ruột thịt
- Ông bà - cháu nghi vấn huyết thống: Xác định dòng tộc
2.2. Mục Đích Pháp Lý
- Làm giấy khai sinh
- Nhập tịch, định cư nước ngoài (theo yêu cầu ĐSQ)
- Thực hiện theo trưng cầu của Tòa Án
2.3. Phụ Nữ Mang Thai
- Xét nghiệm ADN trước sinh không xâm lấn (từ tuần 8) giúp xác định cha của thai nhi
Lưu ý:
- Không giới hạn độ tuổi làm xét nghiệm
- Có thể sử dụng nhiều loại mẫu khác nhau
- Bảo mật tuyệt đối thông tin khách hàng
3. Bảng Giá Xét Nghiệm ADN Tại TP.HCM
Đây là bảng giá niêm yết tham khảo của Gentis TpHCM, bảng giá này chưa áp dụng Khuyến mãi/ Chương trình ưu đãi, Quý Khàng liên hệ hotline để biết chi tiết và chính xác nhất!
|
DỊCH VỤ |
MẪU THƯỜNG |
MẪU ĐẶC BIỆT |
THỜI GIAN |
|
Cha/mẹ - con |
3.000.000đ |
Thêm 2.500.000/mẫu |
1 ngày |
|
Anh/chị em |
5.000.000đ |
Thêm 2.500.000/mẫu |
3-5 ngày |
|
ADN trước sinh |
22.900.000đ - 33.000.000đ |
8-14 ngày |
|
|
ADN pháp lý |
Từ 4.500.000đ |
2 ngày |
4. Quy Trình thu mẫu ADN 3 Bước Đơn Giản
.png)
Trường hợp Khách hàng tự thu mẫu tại nhà
Khách hàng đang ở TP.HCM có thể đến trụ sở chính của Gentis để lấy mẫu đảm bảo độ chính xác, lại tiết kiệm chi phí: 8/24 Nguyễn Đình Khơi, P4, Q.Tân Bình
Hoặc Khách hàng có thể tự thu mẫu tại nhà TP.HCM theo hướng dẫn của chuyên viên Gentis, sau đó gửi mẫu về địa chỉ Trung tâm xét nghiệm ADN của Gentis
Ngoài ra, Gentis TP.HCM đang áp dụng chương trình miễn phí thu mẫu tại nhà cho các khách hàng tại 1 số quận nội thành TP.HCM. Quý Khách hàng vui lòng liên hệ Hotline bên dưới để biết thông tin chi tiết:
Bước 1: Thu mẫu
- Mẫu phổ biến: máu, niêm mạc miệng, tóc nhổ, móng tay/móng chân, cuống rốn,…
- Mẫu đặc biệt: bàn chải đánh răng, dịch quần lót, đầu lọc thuốc lá,...
- Mẫu do nhân viên thu mẫu trực tiếp thu hoặc khách hàng tự thu mẫu gửi đến
Bước 2: Phân tích ADN
- Mẫu được gửi về phòng lab hiện đại đạt chuẩn ISO 9001:2015
- Sử dụng công nghệ giải trình tự gen thế hệ mới
Bước 3: Nhận kết quả
- Thời gian trả kết quả:
- Tiêu chuẩn: 1-3 ngày
- Nhanh: 6h hoặc 24h (có phí bổ sung)
- Kết quả được bảo mật tuyệt đối, gửi qua email, bản cứng,…
5. Lý Do Chọn GENTIS TP.HCM
- Độ chính xác 99,9999% - Pháp lý cao, công nhận toàn quốc
- Bảo mật tuyệt đối - Cam kết không tiết lộ thông tin
- Thu mẫu tại nhà - Tiện lợi khắp 24 quận huyện tại TpHCM
- Trả kết quả nhanh - Có dịch vụ 6h, 24h
6. Địa Chỉ GENTIS Tại TP.HCM

- Địa chỉ: 8/24 Nguyễn Đình Khơi, P4, Quận Tân Bình, TP.HCM
- Hotline: 0888.40.2010
- Tổng đài (miễn phí): 1800 2010
7. Đặt Lịch Xét Nghiệm Ngay tại TpHCM
Khách hàng làm xét nghiệm ADN tại TpHCM có thể đặt lịch trực tiếp qua hotline, tổng đài miễn phí, qua điền form của webiste, qua Fanpage Gentis, Zalo hoặc trực tiếp tại Trụ sở Gentis TpHCM
- Hotline: 0833202929
- Tổng đài miễn phí cước gọi: 18002010
- Website: gentis.vn, gentis.com.vn
- Facebook: https://fb.com/gentishcm
GENTIS TP.HCM - Địa chỉ vàng cho xét nghiệm ADN chính xác, bảo mật!
[content_more] => [meta_title] => Xét nghiệm ADN TpHCM uy tín chính xác 99.999% - Bảo mật thông tin [meta_description] => Xét nghiệm ADN TpHCM uy tín chính xác - xét nghiệm ADN huyết thống, hành chính, khai sinh. Phòng xét nghiệm ADN đạt chuẩn Quốc tế ISO/ IEC/ CAP [meta_keyword] => xét nghiệm ADN,TpHCM,HCM,Tp Hồ Chí Minh [thumbnail_alt] => Xét nghiệm ADN TpHCM uy tín chính xác bảo mật [post_id] => 1322 [category_id] => 15 ) )Xét Nghiệm ADN Tại Nha Trang | GENTIS - Uy Tín, Chính Xác, Bảo Mật
Dịch Vụ Xét Nghiệm ADN Gentis Tại Quảng Ngãi – Nhanh Chóng, Chính Xác, Bảo Mật
Xét nghiệm ADN tại Gentis Vũng Tàu: Uy tín, Chính xác và Tiện lợi
Xét Nghiệm ADN Ở Đà Lạt | GENTIS - Độ Chính Xác Cao, Bảo Mật Tuyệt Đối
Xét Nghiệm ADN Cần Thơ tại Gentis: Uy Tín, Chính Xác, Bảo Mật
Xét Nghiệm ADN Tại Đồng Nai - Uy tín Bảo mật & Chính Xác Từ GENTIS
Xét Nghiệm ADN Tại Bình Dương – Dịch Vụ Chính Xác & Bảo Mật Từ GENTIS
Xét Nghiệm ADN TP.HCM | GENTIS - Chính Xác 99,9%, Bảo Mật Tuyệt Đối
Quý khách vui lòng điền thông tin bên dưới để được hỗ trợ,
tư vấn một cách tốt nhất!
Quý khách vui lòng điền thông tin bên dưới để được hỗ trợ,
tư vấn một cách tốt nhất!

.jpg)