1. Giới thiệu về phôi khảm
Phôi khảm là sự hiện diện của hai hoặc nhiều dòng tế bào với các bộ nhiễm sắc thể khác nhau trong cùng một phôi (Hình 1). Hiện tượng khảm xuất hiện tương đối phổ biến ở giai đoạn tiền làm tổ, ảnh hưởng lên khoảng 20-30% phôi giai đoạn phân cắt và phôi nang [2]. Bên cạnh đó, các nghiên cứu hồi cứu về ảnh hưởng của chất lượng tinh trùng đến kết quả phôi khảm cho biết thêm rằng tỷ lệ phôi khảm thường gặp cao hơn ở các gia đình mà người chồng có số lượng tinh trùng thấp [3,4], thiểu tinh hoặc vô tinh [5,6].
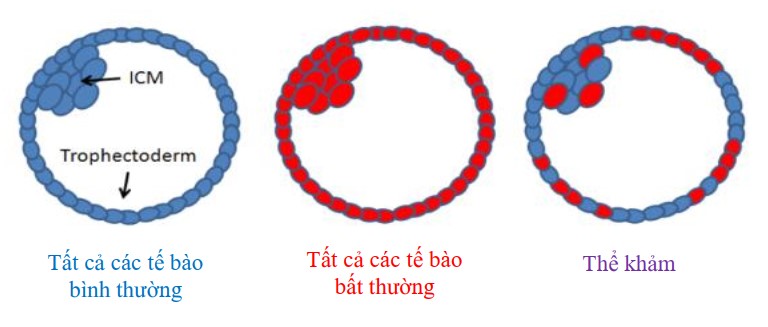 Hình 1: Phôi khảm là phôi mà sự bất thường về NST chỉ xảy ra ở một nhóm tế bào, không phải ở tất cả các tế bào
Hình 1: Phôi khảm là phôi mà sự bất thường về NST chỉ xảy ra ở một nhóm tế bào, không phải ở tất cả các tế bào
Với kỹ thuật phân tích di truyền tiên tiến hiện nay, có thể phát hiện được tỷ lệ khảm dựa vào tỉ lệ số lượng tế bào bất thường NST trên tổng số lượng tế bào sinh thiết. Theo Hiệp hội quốc tế chẩn đoán di truyền tiền làm tổ (PGDIS), để báo cáo kết quả phôi, điểm giới hạn được đề xuất để định nghĩa thể khảm là >20%. Theo đó, <20% được gọi là phôi bình thường (nguyên bội), >80% gọi là phôi bất thường (lệch bội) và nằm trong khoảng từ 20-80% gọi là phôi khảm [1] (Hình 2).
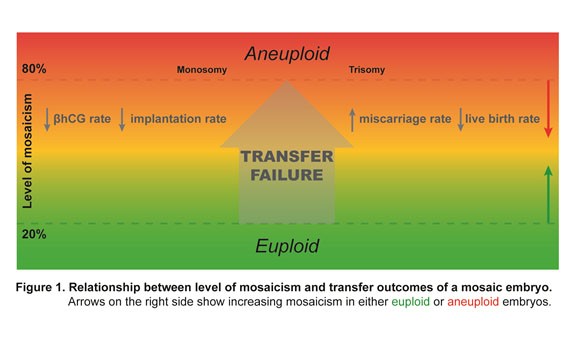 Hình 2: Ngưỡng giới hạn đề xuất định nghĩa phôi khảm
Hình 2: Ngưỡng giới hạn đề xuất định nghĩa phôi khảm
Hiện tượng phôi bị khảm được biết là xảy ra ở một số phôi trong giai đoạn phát triển tiền làm tổ do sai sót trong quá trình phân chia tế bào sau quá trình thụ tinh như: không phân ly nhiễm sắc thể, trễ Anaphase (Anaphase lagging) và nội nhân đôi nhiễm sắc thể (Endoreplication) [2].
- Không phân ly nhiễm sắc thể là toàn bộ nhiễm sắc thể được kéo về một bên cực tế bào thay vì phân chia về hai cực của tế bào, dẫn đến hình thành một tế bào đơn nhiễm và một tế bào tam nhiễm.
- Trễ Anaphase là hiện tượng nhiễm sắc tử không thể gắn vào thoi vô sắc và không thể kết hợp được với nhân, dẫn đến hình thành một tế bào đơn nhiễm và một tế bào hai nhiễm. Nếu việc trễ Anaphase diễn ra trước quá trình biệt hoá, cơ thể tạo ra sẽ mang hai dòng tế bào khác biệt. Nếu xảy ra trong quá trình biệt hoá thì nhau thai phát triển từ nguyên bào nuôi sẽ chứa một dòng tế bào bình thường và một dòng tế bào đơn nhiễm.
- Nội nhân đôi nhiễm sắc thể là sự sao chép của một nhiễm sắc thể mà không có sự phân chia, dẫn đến một tế bào đơn nhiễm mà một tế bào tam nhiễm. Nguyên nhân của hiện tượng này là do sai hỏng trong chu trình tế bào và do quá trình nguyên phân diễn ra trong một khoảng thời gian rất ngắn.
2. Phân loại phôi khảm và ảnh hưởng của phôi khảm tới kết quả PGT-A
Dựa vào dòng tế bào bị ảnh hưởng là tế bào bên trong (ICM) hay tế bào lá nuôi (TE) mà phôi khảm sẽ được chia làm 5 loại chính: phôi khảm toàn bộ, phôi khảm ICM, phôi khảm TE, phôi khảm ICM/TE loại 1 và loại 2 [7]. Và cũng tùy vào từng loại phôi khảm mà giá trị dự đoán của kết quả PGT-A cũng sẽ khác nhau (Hình 3).
Ví dụ: ở trường hợp phôi khảm toàn bộ, nghĩa là xuất hiện các tế bào bất thường nhiễm sắc thể ở cả tế bào ICM và cả tế bào TE. Ở những vị trí sinh thiết tế bào TE khác nhau sẽ cho ra các kết quả PGT-A khác nhau, các trường hợp có thể xảy ra là dự đoán sai (trả kết quả phôi bình thường hoặc phôi bất thường), dự đoán đúng (trả kết quả phôi khảm – kèm tỷ lệ khảm).
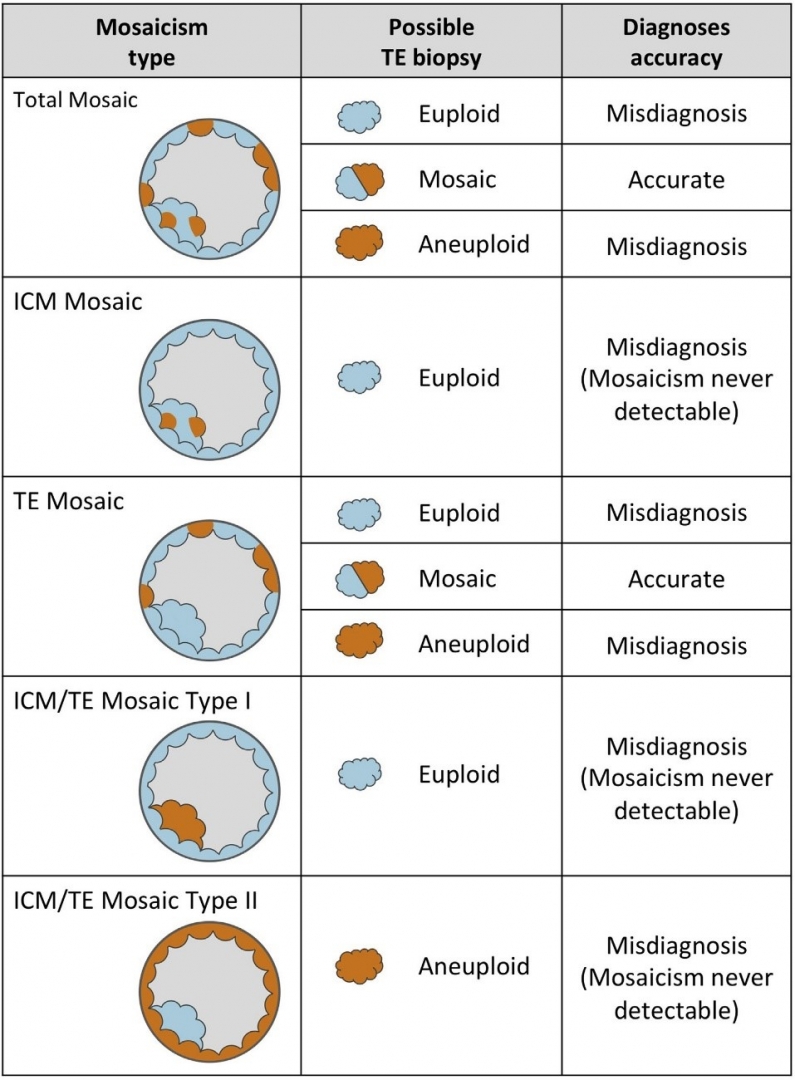 Hình 3: Các loại phôi khảm và ảnh hưởng của phôi khảm tới kết quả PGT-A
Hình 3: Các loại phôi khảm và ảnh hưởng của phôi khảm tới kết quả PGT-A
Có thể thấy, vị trí sinh thiết sẽ ảnh hưởng rất lớn đến giá trị dự đoán của kết quả PGT-A, có thể gây ra các kết quả dương tính giả hay âm tính giả. Bên cạnh đó, các yếu tố như: độ nhạy, độ đặc hiệu của nền tảng thực hiện PGT-A; kỹ thuật phân tích và phần mềm sử dụng; ngưỡng cài đặt cho chú giải thể khảm cũng góp phần vào giá trị dự đoán của kết quả PGT-A. Hiện nay, theo thống kê có khoảng 3-20% số phôi thực hiện PGT-A cho kết quả phôi khảm.
Đã có nhiều câu hỏi được đặt ra, liệu những phôi khảm này có khả năng làm tổ và tạo ra những đứa ra khỏe mạnh không? Và trong những trường hợp cặp vơ chồng thực hiện IVF nhưng kết quả PGT-A không có phôi nguyên bội để chuyển, thì có nên lựa chọn việc chuyển phôi khảm hay không, đây là vấn đề được các y bác sĩ, các nhà chuyên gia đặc biệt quan tâm trong những năm gần đây.
3. Một số kết quả chuyển phôi khảm trong hỗ trợ sinh sản
Cho đến nay, tác động của thể khảm lên sự phát triển của phôi thai vẫn còn gây nhiều tranh cãi. Đã có nhiều nghiên cứu cho thấy thể khảm có liên quan đến sảy thai, dị tật thai nhi và các kết quả chu sinh bất lợi. Tuy nhiên, cũng đã có nhiều báo cáo cho kết quả về khả năng làm tổ và trẻ sinh sống khỏe mạnh từ phôi khảm.
3.1. Phôi khảm thấp có khả năng làm tổ và phát triển thành một đứa trẻ khỏe mạnh về mặt di truyền
Greco và cộng sự (2015) báo cáo về một nghiên cứu chuyển phôi khảm [8]. Nghiên cứu gồm 8 phụ nữ thực hiện IVF chuyển phôi khảm (tỷ lệ khảm từ 30-50%) do không có phôi nguyên bội để chuyển. Kết quả có 6 đứa trẻ khỏe mạnh được sinh ra (Hình 4).
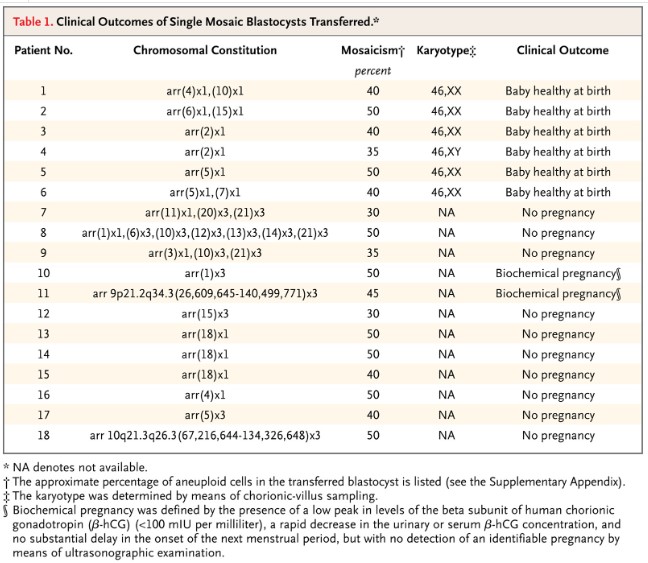 Hình 4: 18 phôi khảm được chuyển và có 6 trẻ khỏe mạnh được sinh ra
Hình 4: 18 phôi khảm được chuyển và có 6 trẻ khỏe mạnh được sinh ra
Trong nghiên cứu của Zhang và cộng sự năm 2019, với 102 phôi khảm ở mức độ <50% được chuyển thì có 46,4% trẻ khỏe mạnh được sinh ra [11]. Bên cạnh đó, nghiên cứu cũng đã thực hiện chuyển 268 phôi nguyên bội để làm nhóm đối chứng, kết quả cho thấy tỷ lệ sinh sống trên mỗi chu kỳ chuyển ở nhóm phôi khảm thấp hơn so với nhóm đối chứng (46,6% so với 59,1%), với tỷ lệ chênh lệch là 0,6 (khoảng tin cậy 95% [CI], 0,38–0,95; P=0,03). Tỷ lệ mang thai sinh hóa ở nhóm chuyển phôi khảm cũng thấp hơn so với nhóm đối chứng (65,7% so với 76,1%), với tỷ lệ chênh lệch là 0,6 (KTC 95%, 0,37–0,99, P=0,043) và không có sự khác biệt đáng kể giữa các nhóm về tỷ lệ mang thai lâm sàng hoặc sảy thai.
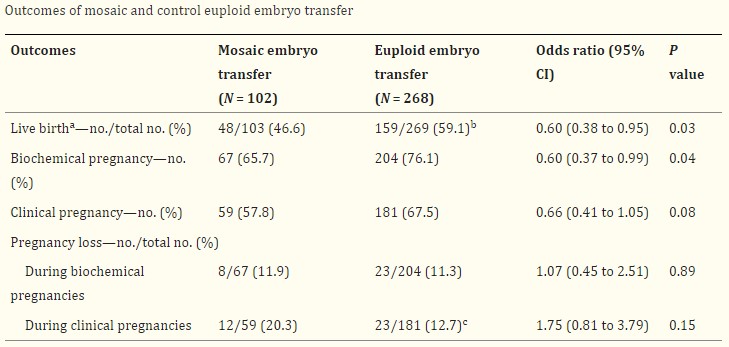 Hình 6: So sánh giữa chuyển phôi khảm và phôi nguyên bội
Hình 6: So sánh giữa chuyển phôi khảm và phôi nguyên bội
3.2. Phôi khảm mức độ thấp có thể cho kết quả về tỷ lệ mang thai, tỷ lệ sảy thai tương đương với phôi nguyên bội
Một nghiên cứu của Capalbo và cộng sự, thực hiện chuyển 6 766 phôi bao gồm: phôi nguyên bội, phôi khảm thấp (20-30%), phôi khảm trung bình (30-50%), phôi khảm cao (50-70%) [9]. Kết quả cho thấy tỷ lệ mang thai, tỷ lệ sẩy thai tương đương nhau giữa phôi nguyên bội và phôi khảm ở mức độ thấp (20-30%)

Một nghiên cứu khác của Spinella và công sự, thực hiện chuyển 77 phôi khảm, do 77 phụ nữ này thực hiện IVF nhưng không có phôi nguyên bội để chuyển [10]. Kết quả có 24 trẻ được sinh ra có karyotype bình thường từ chuyển phôi khảm. Tỉ lệ làm tổ, tỉ lệ thai lâm sàng và tỉ lệ trẻ sinh sống ở nhóm phôi khảm có tỉ lệ lệch bội <50% cao hơn nhiều so với nhóm phôi khảm có tỉ lệ lệch bội ≥50% (Hình 5).
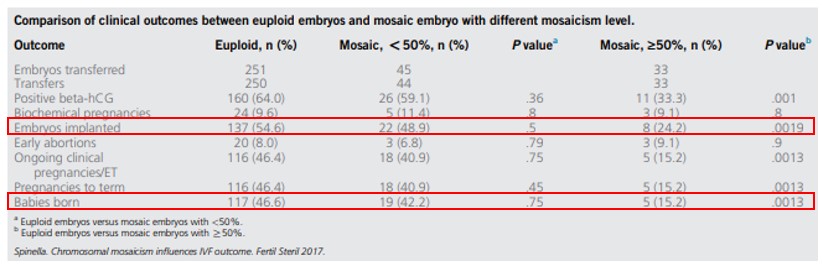
Hình 5: Kết quả chuyển phôi khảm <50% và >50%
4. Kết luận
Có thể thấy, nhiều y văn đã báo cáo rằng việc chuyển phôi khảm cho kết cục thai kỳ thấp hơn đáng kể so với phôi nguyên bội nhưng cũng đã có nhiều nghiên cứu báo cáo các trường hợp trẻ khỏe mạnh được sinh ra, có karyotype bình thường từ những phôi có mức độ khảm thấp. Chính vì vậy, có thể cân nhắc tư vấn chuyển phôi khảm ở mức độ thấp, đặc biệt đối những cặp vợ chồng không có phôi nguyên bội để chuyển với những tiềm năng, lợi ích sau: phôi khảm vẫn có khả năng làm tổ và phát triển thành trẻ khoẻ mạnh; chuyển phôi khảm giúp giảm nguy cơ loại bỏ những phôi có khả năng phát triển tốt, hạn chế số chu kỳ IVF mới cần thực hiện và tăng cơ hội mang thai của phụ nữ thực hiện IVF nhưng không có phôi nguyên bội để chuyển.
Việc chuyển phôi khảm bệnh nhân phải được tư vấn đầy đủ và hướng dẫn về mặt chuyên môn ở mức cao nhất, đảm bảo việc ký kết đồng ý chuyển phôi phải được thực hiện sau khi bệnh nhân được tư vấn và chứng minh rằng đã hiểu rõ. Sau khi chuyển phôi, nên kiểm tra lại bằng chẩn đoán trước sinh. Mẫu dịch ối được khuyến nghị và các kết quả chuyển phôi khảm nên được gửi về phòng lab thực hiện xét nghiệm PGT-A để thu thập dữ liệu cho việc tinh chỉnh và cải thiện các khuyến cáo thực hành.
Đối với những bệnh nhân không có phôi nguyên bội hay không có điều kiện để thực hiện một chu kỳ IVF mới thì việc chuyển phôi khảm được gợi ý và có thể là con đường khả thi duy nhất để mang thai. Và trong tương lai, với nhiều kết quả, bằng chứng nghiên cứu lâm sàng hơn, các bác sĩ, chuyên gia sẽ có những đánh giá và chỉ định kịp thời hơn, giúp nhiều cặp vợ chồng có cơ hội sinh con khỏe mạnh hơn.
Tài liệu tham khảo:
[1] PGDIS Position Statement on the Transfer of Mosaic Embryos 2021
[2] Levy B, Hoffmann ER, McCoy RC, Grati FR. Chromosomal mosaicism: Origins and clinical implications in preimplantation and prenatal diagnosis. Prenat Diagn. 2021;41(5):631-641. doi:10.1002/pd.5931
[3] Tarozzi, N., Nadalini, M., & Borini, A. (2019). Effect on Sperm DNA Quality Following Sperm Selection for ART: New Insights. Advances in experimental medicine and biology, 1166, 169–187. https://doi.org/10.1007/978-3-030-21664-1_10
[4] Kahraman, S., Sahin, Y., Yelke, H., Kumtepe, Y., Tufekci, M. A., Yapan, C. C., Yesil, M., & Cetinkaya, M. (2020). High rates of aneuploidy, mosaicism and abnormal morphokinetic development in cases with low sperm concentration. Journal of assisted reproduction and genetics, 37(3), 629–640. https://doi.org/10.1007/s10815-019-01673-w
[5] Silber, S., Escudero, T., Lenahan, K., Abdelhadi, I., Kilani, Z., & Munné, S. (2003). Chromosomal abnormalities in embryos derived from testicular sperm extraction. Fertility and sterility, 79(1), 30–38. https://doi.org/10.1016/s0015-0282(02)04407-2
[6] Rodrigo L. (2020). Sperm genetic abnormalities and their contribution to embryo aneuploidy & miscarriage. Best practice & research. Clinical endocrinology & metabolism, 34(6), 101477. https://doi.org/10.1016/j.beem.2020.101477
[7] Vera-Rodriguez, M., & Rubio, C. (2017). Assessing the true incidence of mosaicism in preimplantation embryos. Fertility and sterility, 107(5), 1107–1112. https://doi.org/10.1016/j.fertnstert.2017.03.019
[8] Greco E, Minasi MG, Fiorentino F. Healthy Babies after Intrauterine Transfer of Mosaic Aneuploid Blastocysts. N Engl J Med. 2015;373(21):2089-2090. doi:10.1056/NEJMc1500421
[9] Capalbo A, Poli M, Rienzi L, et al. Mosaic human preimplantation embryos and their developmental potential in a prospective, non-selection clinical trial. Am J Hum Genet. 2021;108(12):2238-2247. doi:10.1016/j.ajhg.2021.11.002
[10] Spinella F, Fiorentino F, Biricik A, et al. Extent of chromosomal mosaicism influences the clinical outcome of in vitro fertilization treatments. Fertil Steril. 2018;109(1):77-83. doi:10.1016/j.fertnstert.2017.09.025
[11] Zhang, L., Wei, D., Zhu, Y., Gao, Y., Yan, J., & Chen, Z. J. (2019). Rates of live birth after mosaic embryo transfer compared with euploid embryo transfer. Journal of assisted reproduction and genetics, 36(1), 165–172. https://doi.org/10.1007/s10815-018-1322-2











