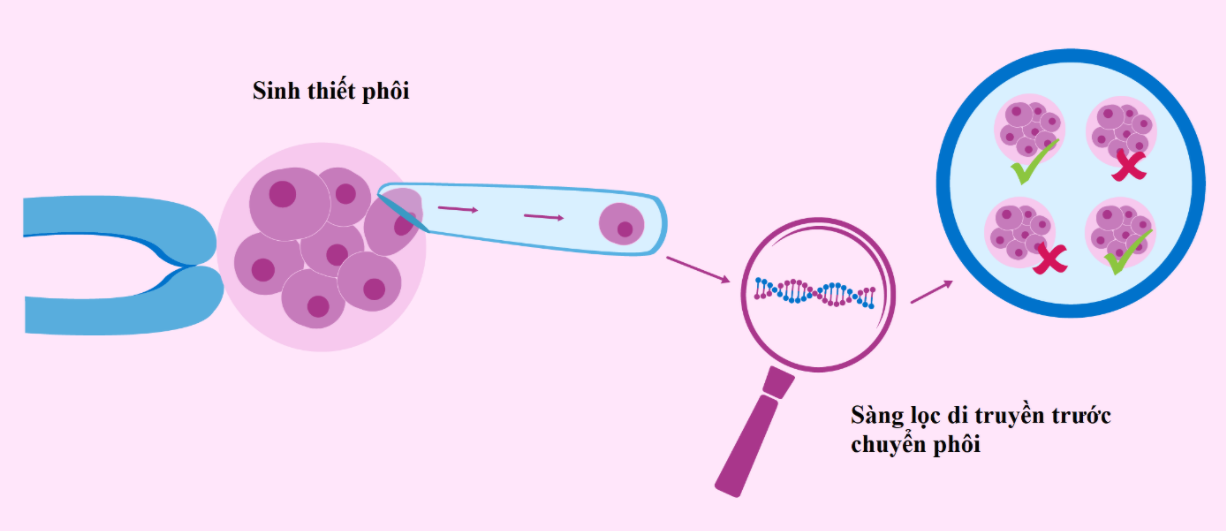
Những năm gần đây, tỷ lệ vô sinh liên tục tăng và ngày càng có nhiều cặp vợ chồng lựa chọn sử dụng công nghệ hỗ trợ sinh sản để điều trị hiếm muộn [1]. Một trong số đó là phương pháp thụ tinh trong ống nghiệm (IVF) với tỷ lệ thực hiện nhiều nhất. Mục tiêu của IVF là chọn được phôi tốt để chuyển vào tử cung của người mẹ và tạo ra một thai lâm sàng khỏe mạnh trong thời gian ngắn nhất.
Tuy nhiên, tỷ lệ xảy ra bất thường nhiễm sắc thể ở phôi nuôi cấy trong ống nghiệm có thể lên đến 60% và điều này liên quan chặt chẽ đến việc cấy ghép thất bại và sảy thai với tỷ lệ cao [2]. Chính vì vậy, xét nghiệm phân tích di truyền trước chuyển phôi hay còn được gọi là PGTest (Preimplantation Genetic Testing) được ra đời và đánh dấu một bước ngoặt lớn trong lĩnh vực hỗ trợ sinh sản. Đến nay, xét nghiệm PGTest đã trở thành một phương pháp thường quy để kiểm tra các bất thường liên quan đến số lượng, cấu trúc của NST và các rối loạn di truyền bệnh đơn gen ở phôi trên toàn thế giới.
Công nghệ, kỹ thuật ứng dụng trong xét nghiệm PGTest
Quy trình thực hiện xét nghiệm PGTest khá phức tạp và yêu cầu cần có đội ngũ nhân sự chuyên môn cao cùng cơ sở vật chất, trang thiết bị hiện đại. Từ khi ra đời, xét nghiệm PGTest luôn được cập nhật, tối ưu về công nghệ để nâng cao hiệu quả sàng lọc. Đến nay, với sự phát triển của khoa học kỹ thuật, đã có nhiều công nghệ được phát triển và sử dụng để phân tích di truyền trước chuyển phôi như:
- Kỹ thuật lai tại chỗ phát huỳnh quang (Fluorescence in situ hydridization - FISH)
- Lai so sánh hệ gen dựa trên microarray (Microarray comparative genomic hybridization - aCGH)
- Công nghệ giải trình tự gen thế hệ mới (Next generation sequencing - NGS).
Mỗi phương pháp có ưu và nhược điểm riêng, vậy đâu là phương pháp để phân tích di truyền trước chuyển phôi có độ chính xác cao nhất và chi phí hợp lý nhất?
1. FISH - Kỹ thuật lai tại chỗ phát huỳnh quang (Fluorescence in situ hydridization)
Năm 1995, kỹ thuật lai tại chỗ phát huỳnh quang (Fluorescence in situ hydridization – FISH) được ứng dụng đầu tiên và xem là phương pháp chủ đạo để phân tích di truyền trước chuyển phôi thời bấy giờ [4].
FISH là một kỹ thuật lai hóa các đoạn đầu dò (chuỗi DNA) có gắn chất phát huỳnh quang với DNA đích trên các NST dưới dạng tế bào phân chia (metaphase) hay không phân chia (interphase). Trải qua các bước cố định tiêu bản, biến tính, lai hóa với đoạn DNA có gắn chất phát huỳnh quang, mẫu sẽ được phân tích dưới kính hiển vi huỳnh quang nhằm phát hiện những bất thường về NST và các gen liên quan.
Tuy nhiên, FISH bị hạn chế bởi số lượng đầu dò huỳnh quang, chính vì vậy đã hạn chế số lượng nhiễm sắc thể được thử nghiệm. Phân tích di truyền trước chuyển phôi sử dụng FISH chỉ cho phép thử nghiệm trên năm nhiễm sắc thể là 13, 18, 21, X và Y [5]. Ngoài ra, việc phát hiện tình trạng thể khảm hay các đột biến vi mất/ lặp đoạn ở phôi còn nhiều hạn chế.
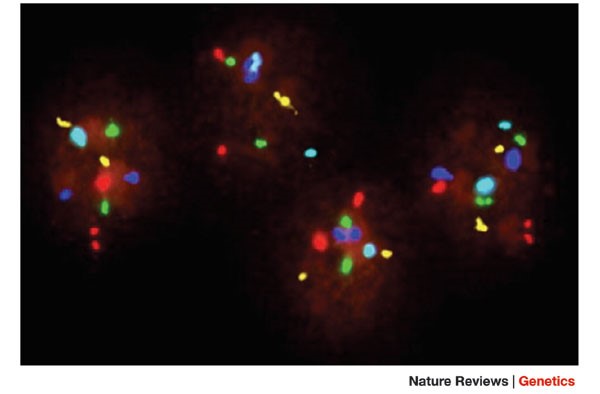 Sàng lọc lệch bội NST số 13, 18, 21, X và Y ở phôi sử dụng phương pháp FISH
Sàng lọc lệch bội NST số 13, 18, 21, X và Y ở phôi sử dụng phương pháp FISH
2. Kỹ thuật lai so sánh hệ gen dựa trên Microarray
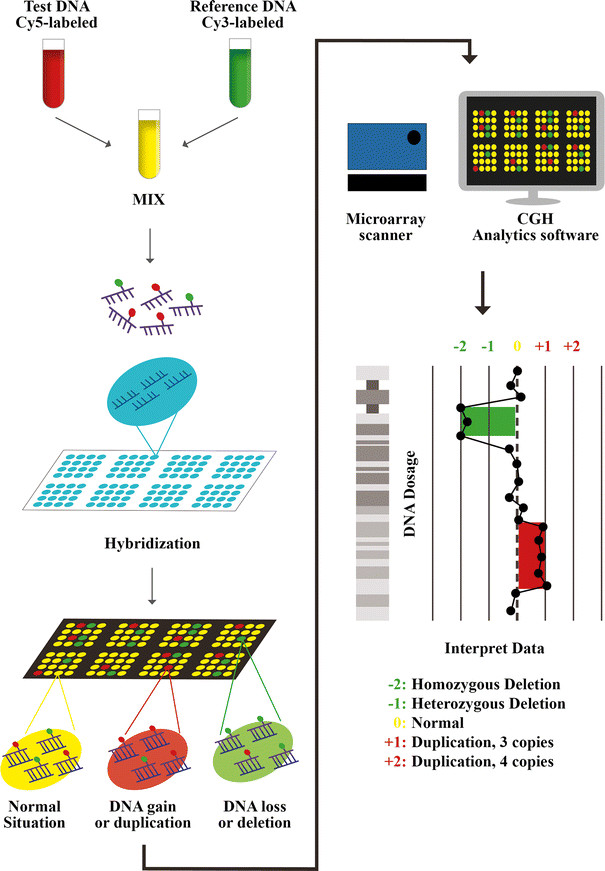
Phương pháp lai so sánh hệ gen dựa trên microarray (aCGH) được ứng dụng tiếp theo ngay sau FISH. Đây là một kỹ thuật tế bào học phân tử để phát hiện sự thay đổi số lượng nhiễm sắc thể trên toàn bộ hệ gen với độ phân giải cao, aCGH so sánh bộ gen của bệnh nhân với bộ gen tham chiếu và xác định sự khác biệt giữa hai bộ gen và từ đó xác định khu vực mất cân bằng bộ gen ở bệnh nhân.
Kỹ thuật này đã có thể phát hiện được bất thường trên toàn bộ 24 NST và thể khảm ở phôi, vượt trội hơn rất nhiều so với phương pháp FISH trước đó. Tuy nhiên, aCGH vẫn còn rất hạn chế để phát hiện các đột biến vi mất/ lặp đoạn hay các hội chứng liên quan đến bất thường cấu trúc NST.
3. Công nghệ giải trình tự gen thế hệ mới (NGS)
Đây là công nghệ đang được coi là tiêu chuẩn hiện nay trong phân tích di truyền trước chuyển phôi. Khác với hai phương pháp trên, NGS tiếp cận dựa trên việc xác định trực tiếp trình tự axit nucleic của một phân tử DNA hoặc cDNA nhất định. NGS giúp giải quyết các bộ dữ liệu quy mô lớn hơn, với chi phí định kỳ thấp hơn rất nhiều.
Khi so sánh với hai phương pháp kể trên, các nhà nghiên cứu đã chỉ ra rằng:
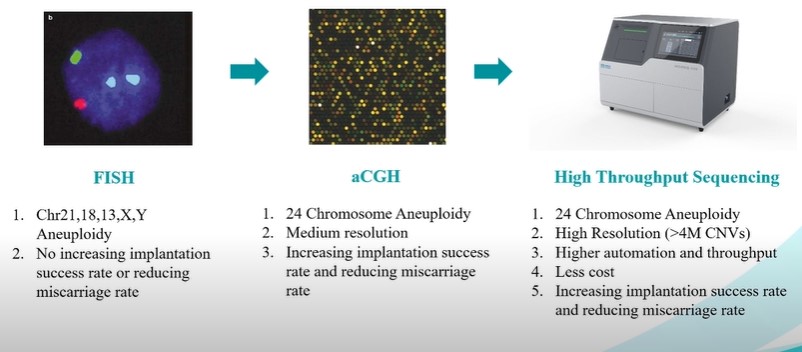
(1) FISH phát hiện các bất thường NST hạn chế hơn rất nhiều so với aCGH và NGS, vì FISH chỉ phát hiện bất thường trên năm NST là 13, 18, 21, X và Y còn aCGH và NGS thì có thể phát hiện bất thường NST trên toàn bộ 24 NST [6];
(2) Sử dụng công nghệ giải trình tự gen thế hệ mới (NGS) giúp cải thiện tỷ lệ sống liên quan đến khả năng phát hiện phôi bất thường tốt hơn so với công nghệ FISH và aCGH [7].
Từ đó thấy rằng, việc ứng dụng công nghệ NGS trong xét nghiệm phân tích di truyền trước chuyển phôi đã cải thiện và nâng cao được hiệu quả sàng lọc các bất thường ở phôi, giúp làm tăng tỉ lệ đậu thai và sinh ra trẻ khỏe mạnh.
 So sánh giữa các phương pháp được ứng dụng trong xét nghiệm PGTest
So sánh giữa các phương pháp được ứng dụng trong xét nghiệm PGTest
Giải trình tự gen thế hệ mới – NGS cũng có nhiều nền tảng khác nhau, kể đến là: giải trình tự Illumina, giải trình tự Proton/PGM (Ion Torrent) và giải trình tự PacBio RS II. Mỗi công nghệ có ưu điểm và nhược điểm riêng, các nghiên cứu trên thế giới cũng đã đánh giá tính hiệu quả của mỗi nền tảng công nghệ khi ứng dụng trong phân tích di truyền trước chuyển phôi. Ưu điểm chung của các nền tảng giải trình tự gen thế hệ mới là phân tích được toàn bộ 24 NST, phát hiện các đột biến vi mất/ lặp đoạn và một số các hội chứng liên quan đến bất thường cấu trúc NST.
Bảng 1: So sánh các nền tảng công nghệ NGS ứng dụng trong PGTest
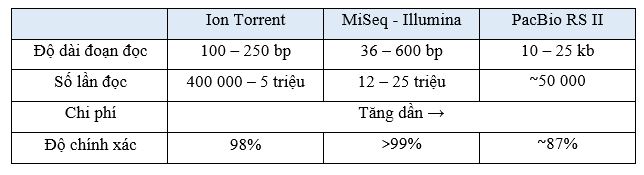
Nền tảng giải trình tự Ion Torrent vì sử dụng công nghệ bán dẫn chứ không phải quang học để đo tín hiệu nên thời gian đọc và phân tích kết quả nhanh, hệ thống máy gọn nhẹ. Nhưng hạn chế của Ion Torrent chính là chiều dài đọc chỉ khoảng 100 – 250 bp, vì vậy mà ở các base phía sau khả năng đọc sẽ giảm dần và khó đếm được chính xác trình tự lặp lại liên tục của một loại nucleotide. Mặc dù hệ thống máy gọn nhẹ nhưng quy trình thực thực hiện lại tương đối phức tạp và gồm nhiều bước, đây cũng chính là một nguyên nhân dẫn đến có sự sai số từ nhiều giai đoạn của quá trình xét nghiệm [8].
Còn với nền tảng công nghệ của Illumina có ưu diểm vượt trội là về khả năng phân tích được các trình tự của một loại nucleotide lặp lại liên tục và với chiều dài đọc là 36 – 600 bp lớn hơn nền tảng của Ion Torrent. Ngoài ra, nền tảng công nghệ của llumina cũng được chứng minh là có độ bao phủ đoạn đọc lớn, tăng khả năng đọc kết quả một cách tối ưu nhất.
Theo thống kê năm 2020, hiện nền tảng công nghệ của Illumina được cộng đồng các nhà khoa học trên thế giới sử dụng phổ biến hơn nền tảng công nghệ Ion Torrent. Tuy nhiên, giải trình tự Illumina lại có nhược điểm là thời gian phân tích dữ liệu lâu hơn cũng như là giá thành cao hơn so với công nghệ Ion Torrent.
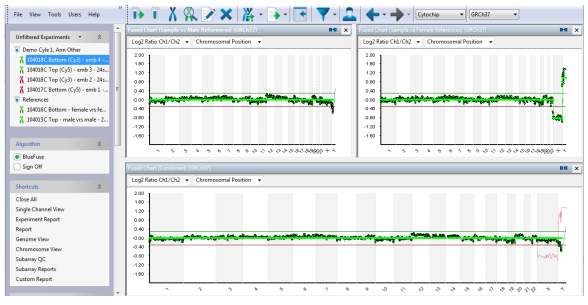
Công nghệ NGS Illumina sử dụng công nghệ sinh tổng hợp và phân mềm phân tích BlueFuse Multi với độ chính xác
Nền tảng công nghệ của PacBio RS II được phát triển tiếp sau nền tảng công nghệ của Illumina, với ưu điểm về chiều dài đoạn đọc lớn, khoảng 10 – 15 kb với thời gian phân tích kết quả nhanh hơn đáng kể so với Ion Torrent và Illumina. Tuy nhiên, giải trình tự PacBio RS II lại có thông lượng thấp, số lần đọc của PacBio RS II chỉ khoảng 50 000 trên một lần chạy, chính vì vậy mà tỷ lệ sai số còn cao, và chi phí xét nghiệm cũng cao hơn hẳn so với hai nền tảng Ion Torrent và Illumina [9]
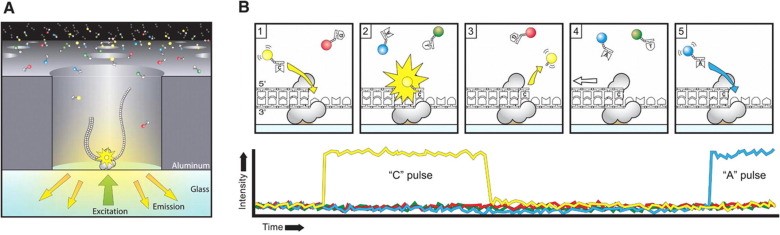 Nguyên lý của nền tảng công nghệ giải trình tự gen PacBio RS II
Nguyên lý của nền tảng công nghệ giải trình tự gen PacBio RS II
Với các nền tảng công nghệ giải trình tự gen thế hệ mới (NGS), ưu điểm vượt trội là về độ phân giải và bao phủ sâu, khả năng sàng lọc và phát hiện các bất thường với độ chính xác cao. Đặc biệt, nền tảng công nghệ của Illumina được xem là xu hướng với các ưu điểm về khả năng phân tích bao phủ sâu hơn nên độ chính xác cũng cao hơn, giá thành hợp lý, khả năng ứng dụng rộng rãi và được xem là tiêu chuẩn trong phân tích di truyền trước chuyển phôi.
Nền tảng công nghệ của xét nghiệm PGTest tại GENTIS
Nền tảng công nghệ được sử dụng trong xét nghiệm này là giải trình tự Illumina trên hệ thống máy MiSeq – Illumina, Hoa Kỳ và phần mềm phân tích BlueFuse Multi đã được chứng minh là có độ nhạy, độ đặc hiệu lên tới 99%. Với những ưu điểm của nền tảng công nghệ Illumina như: khả năng phân tích bao phủ sâu, đọc được các trình tự lặp lại liên tục của một nucleotide, xét nghiệm PGTesst tại GENTIS giúp tăng tỉ lệ chọn được phôi có chất lượng tốt để chuyển vào tử cung người mẹ, từ đó tăng tỷ lệ mang thai lâm sàng thành công khi thực hiện phương pháp thụ tinh trong ống nghiệm (IVF).

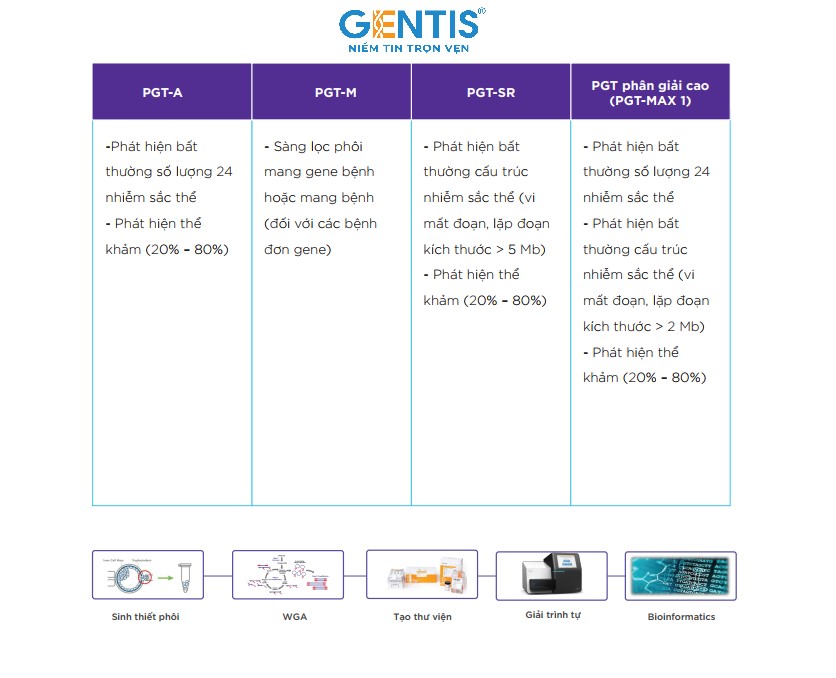
GENTIS đang cung cấp 3 gói xét nghiệm di truyền trước chuyển phôi PGT-A, PGT-SR và PGT-M giúp chọn lọc các phôi không bị bất thường nhiễm sắc thể, hỗ trợ cho quá trình chọn lọc phôi được tối ưu hóa trước khi chuyển vào tử cung của người mẹ. Bên cạnh đó, GENTIS còn ra mắt gói xét nghiệm PGT Max 1 – một xét nghiệm đột phá từ PGTest, được cải tiến độc quyền với các ưu điểm vượt trội mà chưa đơn vị nào tại Việt Nam thực hiện được.
Điều đặc biệt của xét nghiệm này là ngoài phát hiện được những bất thường về số lượng và cấu trúc trên toàn bộ 24 NST và những hội chứng phổ biến gây ra bởi các đột biến có kích thước >5Mb thì PGT Max 1 còn có thể phát hiện được thêm 2 bất thường vi mất đoạn phổ biến có kích thước nhỏ chỉ 2Mb bao gồm: mất đoạn 22q11.2 (liên quan đến hội chứng DiGeorge) và mất đoạn 1p36 (liên quan đến hội chứng mất đoạn 1p36).
Tại GENTIS, chúng tôi luôn không ngừng cố gắng nâng cao chất lượng dịch vụ, áp dụng các công nghệ, kỹ thuật xét nghiệm hiện đại, tiên tiến nhất để mang tới quý khách hàng những giải pháp toàn diện nhất, góp phần nâng cao hiệu quả chăm sóc và bảo vệ sức khỏe con người.
Tài liệu tham khảo:
[1] Vander Borght M., Wyns C. Fertility and infertility: definition and epidemiology. ClinicalBiochemistry . 2018;62:2–10. doi: 10.1016/j.clinbiochem.2018.03.012.
[2] Franasiak J. M., Forman E. J., Hong K. H., et al. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening. Fertility and Sterility . 2014;101(3):656–663. doi: 10.1016/j.fertnstert.2013.11.004.
[3] Handyside, A H et al. “Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification.” Nature vol. 344,6268 (1990): 768-70. doi:10.1038/344768a0
[4] Griffin D.K., Ogur C. Chromosomal analysis in IVF: Just how useful is it? Reproduction. 2018;156:F29–F50. doi: 10.1530/REP-17-0683.
[5] Rius M., Obradors A., Daina G., Ramos L., Pujol A., Martínez-Passarell O. Detection of unbalanced chromosome segregations in preimplantation genetic diagnosis of translocations by short comparative genomic hybridization. Fertil Steril. 2011;96:134–142.
[6] Cornelisse, Simone et al. “Preimplantation genetic testing for aneuploidies (abnormal number of chromosomes) in in vitro fertilisation.” The Cochrane database of systematic reviews vol. 9,9 CD005291. 8 Sep. 2020, doi:10.1002/14651858.CD005291.pub3
[7] Bartels, Chantal B et al. “In vitro fertilization outcomes after preimplantation genetic testing for chromosomal structural rearrangements comparing fluorescence in-situ hybridization, microarray comparative genomic hybridization, and next-generation sequencing.” F&S reports vol. 1,3 249-256. 25 Sep. 2020, doi:10.1016/j.xfre.2020.09.011
[8] Lahens, Nicholas F et al. “A comparison of Illumina and Ion Torrent sequencing platforms in the context of differential gene expression.” BMC genomics vol. 18,1 602. 10 Aug. 2017, doi:10.1186/s12864-017-4011-0
[9] Rhoads, Anthony, and Kin Fai Au. “PacBio Sequencing and Its Applications.” Genomics, proteomics & bioinformatics vol. 13,5 (2015): 278-89. doi:10.1016/j.gpb.2015.08.002











