Vô sinh được định nghĩa là sự thất bại của một cặp vợ chồng để đạt được thai kỳ lâm sàng sau một năm quan hệ tình dục thường xuyên, không dùng các biện pháp bảo vệ. Hiện nay, vô sinh đang ảnh hưởng đến hơn 180 triệu người trên toàn thế giới, trong đó yếu tố vô sinh nam giới được tìm thấy ở gần 10% ở các cặp vợ chồng và chịu trách nhiệm cho khoảng 50% nguyên nhân gây ra vô sinh.
Vô sinh nam được biết đến là rối loạn của hệ thống sinh sản, chủ yếu gây ra bởi các yếu tố liên quan đến tinh dịch, di truyền và bẩm sinh, khiếm khuyết giải phẫu, rối loạn nội tiết, bất thường về miễn dịch hoặc chức năng,…[1]. Đánh giá khả năng sinh sản của nam giới vẫn dựa vào phân tích tinh dịch thông thường.
Trên thực tế, khoảng 15% bệnh nhân vô sinh có phân tích tinh dịch đồ bình thường. Tuy nhiên, đánh giá nồng độ tinh trùng, khả năng vận động và hình thái có thể không phản ánh đầy đủ tính toàn vẹn DNA tinh trùng, gây bất lợi cho việc thụ tinh bình thường, phát triển phôi và thành công của công nghệ hỗ trợ sinh sản [2], trong khi tính toàn vẹn DNA của tinh trùng có vai trò quan trọng, không thể thiếu đối với sự ra đời khỏe mạnh của con cái.
Ngày càng có nhiều bằng chứng chỉ ra sự phân mảnh DNA tinh trùng (SDF), dấu hiệu của nhiễm sắc thể bị tổn thương, có vai trò độc lập và đáng chú ý trong vô sinh nam và tỷ lệ thành công sinh sản [3,4,5]. Nguyên nhân dẫn tới phân mảnh ADN tinh trùng bao gồm cả yếu tố nội sinh và ngoại sinh.
 Nguồn hình ảnh: Agarwal, A., Majzoub, A., Baskaran, S., Panner Selvam, M. K., Cho, C. L., Henkel, R., Finelli, R., Leisegang, K., Sengupta, P., Barbarosie, C., Parekh, N., Alves, M. G., Ko, E., Arafa, M., Tadros, N., Ramasamy, R., Kavoussi, P., Ambar, R., Kuchakulla, M., Robert, K. A., … Shah, R. (2020). Sperm DNA Fragmentation: A New Guideline for Clinicians. The world journal of men's health, 38(4), 412–471.
Nguồn hình ảnh: Agarwal, A., Majzoub, A., Baskaran, S., Panner Selvam, M. K., Cho, C. L., Henkel, R., Finelli, R., Leisegang, K., Sengupta, P., Barbarosie, C., Parekh, N., Alves, M. G., Ko, E., Arafa, M., Tadros, N., Ramasamy, R., Kavoussi, P., Ambar, R., Kuchakulla, M., Robert, K. A., … Shah, R. (2020). Sperm DNA Fragmentation: A New Guideline for Clinicians. The world journal of men's health, 38(4), 412–471.
Tinh trùng là kết quả của quá trình phức tạp và sự biệt hóa tế bào. Giai đoạn chính của giảm phân là ở kì đầu I, nơi các tế bào sinh tinh tạo ra sự phá vỡ DNA chuỗi kép (double strand DNA breaks - DSB) thông qua protein SPO11.
DSB là cần thiết cho các nhiễm sắc thể tương đồng để diễn ra quá trình tái tổ hợp DNA. DSB kích hoạt hệ thống sửa chữa DNA thông qua protein kinase ataxia-telangiectasia đột biến (ATM) để sửa chữa các đầu tự do và tạo ra điểm tiếp xúc (chiasma) bằng cách tái tổ hợp tương đồng và ATM cũng chịu trách nhiệm ức chế sự hình thành DSB mới bởi SPO11.
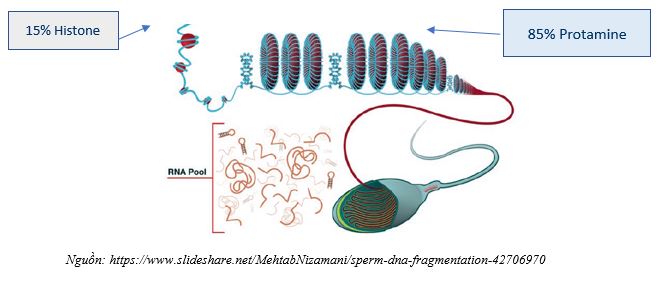
Sau khi giảm phân, tinh trùng trải qua quá trình biệt hóa tế bào, chúng mất hầu hết các phần của tế bào chất, hình thành midpiece và đuôi để có khả năng vận động sau khi xuất tinh. Tuy nhiên, về mặt chất nhiễm sắc, sự thay đổi quan trọng nhất xảy ra ở tinh trùng là sự thay thế histones bằng các protamine, điều này xảy ra khoảng 85% DNA tinh trùng và giữ chúng trong cấu trúc hình xuyến liên kết với ma trận hạt nhân bởi các vùng đính kèm ma trận (vùng MAR).
Các vùng MAR này vẫn được nén bởi histones và chiếm một phần rất nhỏ của bộ gen, khoảng 15% của nhiễm sắc thể tinh trùng. Việc siêu nén DNA này với các protamines, kết hợp với một cấu trúc di động của tế bào, cung cấp cho tinh trùng khả năng hoàn hảo để mang vật liệu di truyền đến tế bào trứng để tạo thành hợp tử. Rõ ràng nếu cấu trúc này có chứa sự thay đổi, những điều này có thể ảnh hưởng đến hợp tử theo một cách nào đó [9].
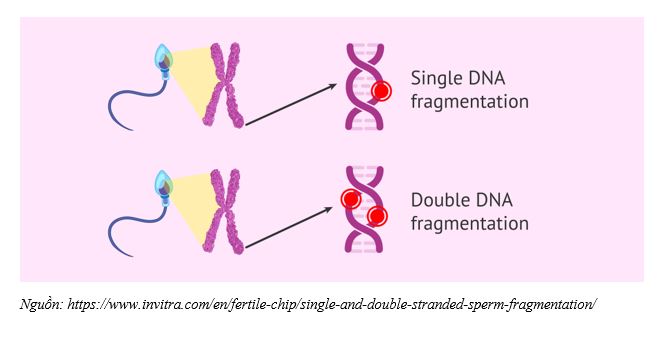
Phân mảnh DNA của tinh trùng (Sperm DNA Fragmentation - SDF), hoặc phân mảnh tinh trùng (Sperm Fragmentation), đề cập đến các tổn thương hoặc phá vỡ trong vật liệu di truyền của tinh trùng, và là một trong những nguyên nhân chính của vô sinh nam. Phân mảnh DNA tinh trùng (SDF) có thể được gây ra bởi các yếu tố bên ngoài (nghĩa là phơi nhiễm nhiệt, hút thuốc, các chất ô nhiễm môi trường, hóa trị liệu) cũng như các yếu tố bên trong (sự trưởng thành của tế bào mầm khiếm khuyết, apoptosis không hoàn toàn và stress oxy hóa [OS]) [2].
Bệnh nhân bị phân mảnh DNA tinh trùng có thể bị ảnh hưởng xấu đến khả năng thụ tinh, đặc biệt khi mức độ phân mảnh cao. Mức độ stress oxy hóa (OS) gây ra chết tế bào thông qua apoptosis có thể phá vỡ tất cả các khía cạnh chức năng của tinh trùng, bao gồm khả năng vận động, exocytosis acrosomal và phản ứng tổng hợp tế bào sinh tinh. Tuy nhiên, tinh trùng với nhiễm sắc thể hỏng có thể giữ được khả năng thụ tinh của chúng. Nhiều nghiên cứu đánh giá SDF cho thấy tinh trùng vẫn có khả năng thụ tinh có thể được giải thích, ít nhất là một phần, bởi tính chất đa dạng của DNA và khả năng sửa chữa của tế bào trứng [1].
Như đã đề cập, tính toàn vẹn của DNA tinh trùng đóng vai trò quan trọng trong quá trình thụ tinh và phát triển phôi sớm. Khả năng thụ thai tự nhiên có thể bị ảnh hưởng nếu tính toàn vẹn này không được đảm bảo. Nhiều nghiên cứu chỉ ra mức độ SDF cao đi cùng sự phát triển phôi kém, tỷ lệ làm tổ thấp hơn và tỷ lệ xảy thai cao hơn [12].
Trong phân tích tổng hợp bao gồm 3 nghiên cứu và 616 cặp vợ chồng cho thấy mức độ SDF cao liên quan đến khả năng mang thai tự nhiên giảm. Do các khiếm khuyết của tinh trùng có thể không thể quan sát thấy, xét nghiệm SDF có thể mang lại thông tin bổ sung cho đánh giá chất lượng tinh trùng của nam giới [12]. Đối với các phương pháp hỗ trợ sinh sản, DFI cao có thể ảnh hưởng tiêu cực đến kết quả của các kỹ thuật hỗ trợ sinh sản (IUI, IVF/ICSI).
Liên quan đến bơm tinh trùng vào buồng tử cung (IUI), Chen và cộng sự đã phân tích kết quả của 10 nghiên cứu và chứng minh rằng mức độ SDF cao có liên quan đến tỷ lệ mang thai và tỷ lệ sinh thấp hơn đáng kể [13].
Trong nghiên cứu năm 2020 của Sugihara và cộng sự đã phân tích của 3 nghiên cứu và báo cáo rằng trong khi SDF thấp có liên quan đến tỷ lệ mang thai tốt hơn [14].
DFI ảnh hưởng tới sự thành công của IUI, DFI tăng khiến cho tỉ lệ thành công của IUI giảm mạnh [7].
DFI liên hệ đồng biến với tỉ lệ thành công IVF một cách rõ rệt hơn so với tỉ lệ thành công của ICSI [6].
- Nghiên cứu trên 234 cặp đôi với 285 mẫu tinh dịch, cho kết quả không có khác biệt giữa ICSI và IVF khi DFI < 27%, IVF không thể thành công khi DFI > 27% [11].
- Nghiên cứu 203 cặp đôi IVF và 136 cặp đôi ICSI, kết quả IVF thấp hơn đáng kể (13%) khi DFI > 50% và không thấy sự khác nhau khi thực hiện ICSI [11].
- Năm 2021, nghiên cứu thực hiện trên 357 cặp đôi cho thấy tỷ lệ thành công khi thực hiện IUI giảm khi DFI > 20% và tỷ lệ thành công là 0 - 5% khi DFI > 30% [3].
- Có những nghiên cứu cho thấy có sự liên hệ đồng biến giữa DFI và tỉ lệ phôi tốt [13].
- Nghiên cứu thực hiện trên 163 cặp đôi năm 2021, cho thấy DFI > 20% cho tỷ lệ hình thành phôi nang giảm (p < 0,05) và cho tỷ lệ sảy thai cao hơn [10]. DFI liên quan một cách rõ rệt với sảy thai, DFI tăng làm tăng nguy cơ sảy thai [8].
- Năm 2020, nghiên cứu trên 2000 cặp đôi, kết quả cho thấy tỷ lệ mang thai lâm sàng thấp hơn nếu DFI cao (p < 0,05), tỷ lệ mang thai lâm sàng lần lượt là 59,6% (DFI < 15%); 28,3% (15%<DFI<30%); 12,1 (DFI > 40%) [11]. Mức độ DFI cao ảnh hưởng tiêu cực đến kết quả IVF/ICSI.
- Nghiên cứu trên 550 cặp đôi người Trung Quốc (415 thực hiện IVF, 135 thực hiện ICSI), DFI > 22,3% giảm tỷ lệ thành công thụ tinh lâm sàng khi thực hiện IVF/ICSI.
Nhiều nghiên cứu chứng minh SDF cao có liên quan đến việc giảm tỷ lệ mang thai với IUI, IVF và tỷ lệ sảy thai tăng theo cả IVF và ICSI. Tác động tiêu cực của mức độ DFI cao đối với tỷ lệ thành công trong hỗ trợ sinh sản có thể khuyến khích nhiều bác sĩ lâm sàng sử dụng xét nghiệm SDF trong lâm sàng.
Sảy thai tái phát (RPL) là tình trạng sảy thai 3 lần liên tiếp nhau lúc thai nhỏ hơn 20 tuần tuổi hoặc trọng lượng thai nhỏ hơn 500g. Sảy thai trước 20 tuần thai kỳ đã được chứng minh có liên kết với mức độ SDF cao trong một số nghiên cứu. Các nghiên cứu được thực hiện bằng các phương pháp xét nghiệm SDF khác nhau như SCD, TUNEL và SCSA đã báo cáo mức SDF cao hơn đáng kể ở những bệnh nhân mắc RPL so với nhóm chứng bình thường.
- Năm 2019, Tan và cộng sự thực hiện nghiên cứ tổng hợp trên 12 nghiên cứu với 1169 nam giới trong đó 530 nam giới đã mắc RPL đã thực hiện xét nghiệm SDF và 639 nam giới trong nhóm đối chứng. Kết quả nghiên cứu cho thấy các cặp vợ chồng có tiền sử RPL không rõ nguyên nhân có mức SDF cao hơn so với các cặp đôi đối chứng (p < 0,001) [15]. Nghiên cứu trên 872 cặp đôi cho thấy 42,3% nam giới mắc RPL có mức DFI cao (DFI ≥ 30.0%) [11].
- Năm 2020, trong nghiên cứu thực hiện tại Trung Quốc trên 461 nam giới mắc RPL và 411 nam giới trong nhóm đối chứng bình thường, kết quả cho thấy tỷ lệ nam giới bị phân mảnh DNA nghiêm trọng (DFI ≥ 30,0%) cao hơn đáng kể ở nhóm RPL (42,3%) so với nhóm đối chứng (13,1%) [15]. Những kết quả này hỗ trợ giá trị chẩn đoán của SDF so với phân tích tinh dịch thông thường, cũng như hỗ trợ xác định nguyên nhân của RPL không giải thích được.
Vô sinh nam vô căn (UMI) đề cập đến nam giới có kết quả phân tích tinh dịch nằm trong các giá trị bình thường và các bất thường về thể chất cũng như nội tiết đã được loại trừ, nhưng người vợ vẫn chưa có thai sau một năm chung sống, quan hệ tình dục trung bình 2-3 lần/tuần, không sử dụng bất kỳ biện pháp tránh thai nào. Nhiều nghiên cứu cho thấy những người đàn ông có thông số tinh dịch bình thường vẫn có thể có SDF cao.
- Nghiên cứu của Oleszczuk và cộng sự cho thấy 10,5% nam giới có thông số tinh dịch tiêu chuẩn bình thường có mức DFI ≥ 20.0% [50]. Tương tự, vô sinh nam vô căn có liên quan đến SDF cao, nhiều nghiên cứu đã xác nhận mối tương quan nghịch đáng kể giữa mức SDF và số lượng tinh trùng, khả năng vận động và hình thái bình thường [16,17,18].
Trong một tỷ lệ đáng kể của các trường hợp vô sinh nam "không giải thích được", tính toàn vẹn DNA tinh trùng ít nhất có thể giải thích như là một phần của vấn đề về kết quả sinh sản. Xét nghiệm phân mảnh DNA tinh trùng có thể giúp xác định nam giới có vấn đề về khả năng sinh sản và do đó có thể giúp đỡ trong việc tư vấn cho các cặp vợ chồng vô sinh. DFI tinh trùng không tương quan mạnh với các thông số tinh dịch thông thường.
Do đó, xét nghiệm phân mảnh DNA tinh trùng nên được thực hiện như một bước bổ sung trong việc kiểm tra khả năng sinh sản của nam giới[17,18].
>> Xem thêm về dịch vụ xét nghiệm Phân mảnh ADN tinh trùng tại đây
TÀI LIỆU THAM KHẢO
[1] Esteves, S. C., Zini, A., Coward, R. M., Evenson, D. P., Gosálvez, J., Lewis, S., Sharma, R., & Humaidan, P. (2021). Sperm DNA fragmentation testing: Summary evidence and clinical practice recommendations. Andrologia, 53(2), e13874. https://doi.org/10.1111/and.13874
[2] Agarwal, A., Majzoub, A., Baskaran, S., Panner Selvam, M. K., Cho, C. L., Henkel, R., Finelli, R., Leisegang, K., Sengupta, P., Barbarosie, C., Parekh, N., Alves, M. G., Ko, E., Arafa, M., Tadros, N., Ramasamy, R., Kavoussi, P., Ambar, R., Kuchakulla, M., Robert, K. A., … Shah, R. (2020). Sperm DNA Fragmentation: A New Guideline for Clinicians. The world journal of men's health, 38(4), 412–471. https://doi.org/10.5534/wjmh.200128
[3] Rex, A. S., Wu, C., Aagaard, J., & Fedder, J. (2021). DNA Fragmentation in Human Spermatozoa and Pregnancy Rates after Intrauterine Insemination. Should the DFI Threshold Be Lowered?. Journal of clinical medicine, 10(6), 1310. https://doi.org/10.3390/jcm10061310
[4] Zhu, X. B., Chen, Q., Fan, W. M., Niu, Z. H., Xu, B. F., & Zhang, A. J. (2020). Sperm DNA fragmentation in Chinese couples with unexplained recurrent pregnancy loss. Asian journal of andrology, 22(3), 296–301. https://doi.org/10.4103/aja.aja_60_19
[5] Cheng, H., Han, M., Ding, J., Wang, F., Wang, G., Shen, L., Wang, J., Zheng, B., Meng, Q., Wang, W., Yang, S., & Li, H. (2020). Importance of a semen analysis report for determining the relationship between SCSA sperm DNA fragmentation index and assisted reproductive technology pregnancy rate. Reproductive biology, 20(4), 460–464. https://doi.org/10.1016/j.repbio.2019.09.002
[6] Malić Vončina, S., Stenqvist, A., Bungum, M., Schyman, T., & Giwercman, A. (2021). Sperm DNA fragmentation index and cumulative live birth rate in a cohort of 2,713 couples undergoing assisted reproduction treatment. Fertility and sterility, 116(6), 1483–1490. https://doi.org/10.1016/j.fertnstert.2021.06.049
[7] Depuydt, C., Donders, G., Verstraete, L., Beert, J., Salembier, G., Bosmans, E., Dhont, N., Kerkhofs, C., & Ombelet, W. (2021). Negative Impact of Elevated DNA Fragmentation and Human Papillomavirus (HPV) Presence in Sperm on the Outcome of Intra-Uterine Insemination (IUI). Journal of clinical medicine, 10(4), 717. https://doi.org/10.3390/jcm10040717
[8] Duarte, C., Núñez, V., Wong, Y., Vivar, C., Benites, E., Rodriguez, U., Vergara, C., & Ponce, J. (2017). Impact of the Z potential technique on reducing the sperm DNA fragmentation index, fertilization rate and embryo development. JBRA assisted reproduction, 21(4), 351–355. https://doi.org/10.5935/1518-0557.20170055
[9] Deng, C., Li, T., Xie, Y., Guo, Y., Yang, Q. Y., Liang, X., Deng, C. H., & Liu, G. H. (2019). Sperm DNA fragmentation index influences assisted reproductive technology outcome: A systematic review and meta-analysis combined with a retrospective cohort study. Andrologia, 51(6), e13263. https://doi.org/10.1111/and.13263
[10] Ribas-Maynou, J., & Benet, J. (2019). Single and Double Strand Sperm DNA Damage: Different Reproductive Effects on Male Fertility. Genes, 10(2), 105. https://doi.org/10.3390/genes10020105
[11] Martínez, E., Bezazián, C., Bezazián, A., Lindl, K., Peliquero, A., Cattaneo, A., Gnocchi, D., Irigoyen, M., Tessari, L., & Martínez, A. G. (2021). Sperm DNA fragmentation and male age: results of in vitro fertilization treatments. JBRA assisted reproduction, 25(4), 533–539. https://doi.org/10.5935/1518-0557.20210018
[12] Zhu, X. B., Chen, Q., Fan, W. M., Niu, Z. H., Xu, B. F., & Zhang, A. J. (2020). Sperm DNA fragmentation in Chinese couples with unexplained recurrent pregnancy loss. Asian journal of andrology, 22(3), 296–301. https://doi.org/10.4103/aja.aja_60_19
[13] Borges, E., Jr, Zanetti, B. F., Setti, A. S., Braga, D., Provenza, R. R., & Iaconelli, A., Jr (2019). Sperm DNA fragmentation is correlated with poor embryo development, lower implantation rate, and higher miscarriage rate in reproductive cycles of non-male factor infertility. Fertility and sterility, 112(3), 483–490. https://doi.org/10.1016/j.fertnstert.2019.04.029
[14] Zini A. (2011). Are sperm chromatin and DNA defects relevant in the clinic?. Systems biology in reproductive medicine, 57(1-2), 78–85. https://doi.org/10.3109/19396368.2010.515704
[15] Sugihara, A., Van Avermaete, F., Roelant, E., Punjabi, U., & De Neubourg, D. (2020). The role of sperm DNA fragmentation testing in predicting intra-uterine insemination outcome: A systematic review and meta-analysis. European journal of obstetrics, gynecology, and reproductive biology, 244, 8–15. https://doi.org/10.1016/j.ejogrb.2019.10.005
[16] Zhu, X. B., Chen, Q., Fan, W. M., Niu, Z. H., Xu, B. F., & Zhang, A. J. (2020). Sperm DNA fragmentation in Chinese couples with unexplained recurrent pregnancy loss. Asian journal of andrology, 22(3), 296–301. https://doi.org/10.4103/aja.aja_60_19
[17] Majzoub, A., Arafa, M., Mahdi, M., Agarwal, A., Al Said, S., Al-Emadi, I., El Ansari, W., Alattar, A., Al Rumaihi, K., & Elbardisi, H. (2018). Oxidation-reduction potential and sperm DNA fragmentation, and their associations with sperm morphological anomalies amongst fertile and infertile men. Arab journal of urology, 16(1), 87–95. https://doi.org/10.1016/j.aju.2017.11.014
[18] Le, M. T., Nguyen, T., Nguyen, H., Nguyen, T., Nguyen, V. T., Le, D. D., Nguyen, V., & Cao, N. T. (2019). Does sperm DNA fragmentation correlate with semen parameters?. Reproductive medicine and biology, 18(4), 390–396. https://doi.org/10.1002/rmb2.12297.











